Dettagli
- Sommario
- Classificazione
- Fisiopatologia
- Diagnosi
- Compenso
- Gap Anionico
- Esempi clinici
- Punti chiave
Disturbi acido base
Sommario
I disturbi dell’equilibrio acido-base sono un gruppo di condizioni caratterizzate da cambiamenti patologici nella concentrazione di ioni idrogeno (H+) o della pressione parziale di anidride carbonica (pCO2) o del bicarbonato sierico (HCO3–), che portano a cambiamenti nel pH del sangue arterioso.
Queste condizioni possono essere classificate come:
- acidosi se il pH sierico è minore di 7.35. Con il termine acidosi ci si riferisce ai processi fisiologici che provocano accumulo di acidi o perdita di basi.
- alcalosi se il pH sierico è maggiore di 7.45. Con il termine alcalosi ci si riferisce ai processi fisiologici che provocano accumulo di basi o perdita di acidi.
Hanno origine respiratoria o metabolica, a seconda della causa dello squilibrio.
Le effettive variazioni del pH dipendono dal grado di compenso fisiologico e dalla presenza di numerosi processi.
La diagnosi si basa sull’interpretazione dei gas nel sangue arterioso.
Nel contesto dell’acidosi metabolica, il calcolo del gap anionico è una risorsa importante per restringere le possibili cause e raggiungere una diagnosi precisa.
Il trattamento si basa sull’identificazione della causa sottostante.
Classificazione
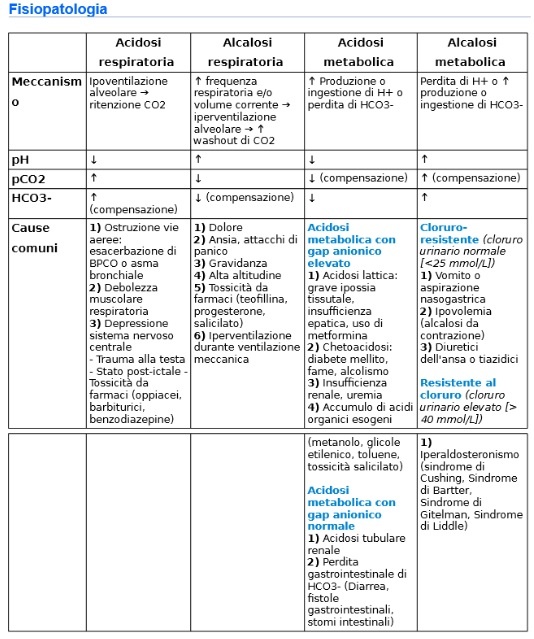
I disturbi primari dell’equilibrio acido-base sono definite come metabolici o respiratori, a seconda del contesto clinico a seconda del caso in cui le modificazioni primitive del pH siano dovute a un’alterazione dei livelli sierici di HCO3− o Pco2.
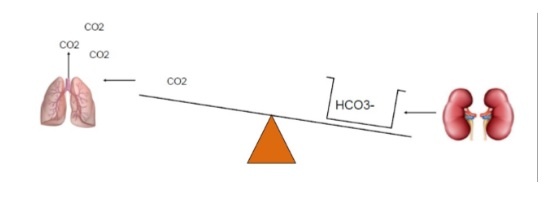
Si ha l’acidosi metabolica quando i livelli sierici di HCO3−< 24 mEq/L. Le cause sono
- Aumento della produzione di acidi
- Ingestione di acidi
- Ridotta escrezione renale di acidi
- Perdita renale o gastrointestinale di HCO3−
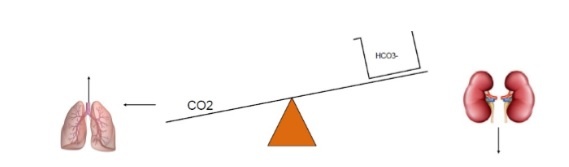
Si ha alcalosi metabolica per livelli di HCO3−> 24 mEq/L. Le cause sono
- Perdita di acidi
- Ritenzione di HCO3−
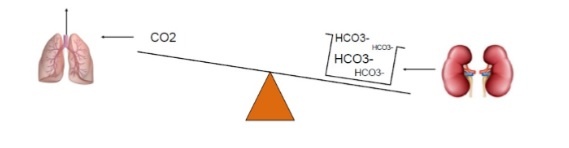
Si ha acidosi respiratoria per concentrazioni di Pco2> 40 mmHg (ipercapnia). La causa è
- Diminuzione della ventilazione/min (ipoventilazione)
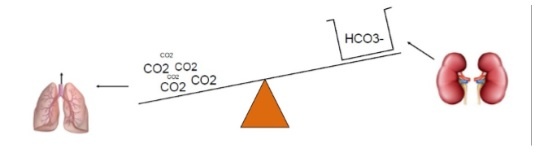
Si ha alcalosi respiratoria per concentrazioni di Pco2< 40 mmHg (ipocapnia). La causa è
- Aumento della ventilazione/min (iperventilazione)
I meccanismi compensatori iniziano con la correzione del pH ogni volta che è presente un disturbo acido-base. Il compenso non può riportare completamente il pH nella norma e non causa mai una compensazione eccessiva.
Un disturbo semplice dell’equilibro acido-base è un disturbo singolo dell’equilibrio acido-base con la sua risposta compensatoria di accompagnamento.
Le alterazioni miste dell’equilibrio acido-base comprendono sempre almeno 2 disturbi primari.
Fisiopatologia
Diagnosi
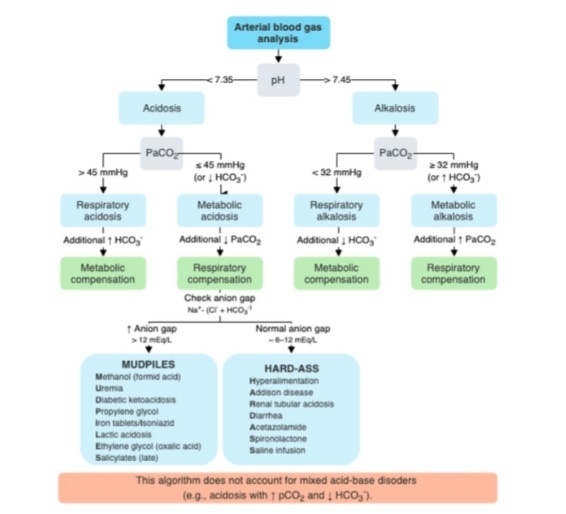
1) Valutare pH e pCO2.
Sono i valori di laboratorio più importanti per valutare lo stato acido-base in qualsiasi paziente. L’ equazione di Henderson-Hasselbalch consente il calcolo di HCO 3 – da questi valori: pH = pKa + log ([ HCO 3 – ] / 0.03 x PCO 2 )
- pH < 7,35 (acidemia) → il disturbo primario è un’acidosi
- pH > 7,45 (alcalemia) → il disturbo primario è un’alcalosi
Valutare pCO2 (pressione parziale di anidride carbonica nel sangue, intervallo di riferimento: 33–45 mm Hg) per determinare se il disturbo acido-base primario è respiratorio o metabolico.
Se pH e pCO2 vanno in direzione opposta → disturbo respiratorio.
- ↓ pH e ↑ pCO2→acidosi respiratoria
- ↑ pH e ↓pCO2→alcalosi respiratoria
Se pH e pCO2 vanno nella stessa direzione → disturbo metabolico
- ↓ pH e ↓ pCO2 → acidosi metabolica (In caso di acidosi metabolica → calcolare il gap anionico per identificare le possibili cause)
- ↑ pH e ↑ pCO2 → alcalosi metabolica
2) Valutare HCO3– (Intervallo di riferimento: 22-28 mEq / L)
- ↑ HCO3-: Alcalosi metabolica o acidosi respiratoria compensata
- ↓ HCO3-: Acidosi metabolica o alcalosi respiratoria compensata
3) Valutare pO2
- ↑: Iperossiemia
- ↓ →ipossiemia
Compenso
Definizione: cambiamenti fisiologici che si verificano nei disturbi acido-base nel tentativo di mantenere un normale pH corporeo
Tipi di meccanismi di compenso:
- Nei disordini metabolici: rapida compensazione in pochi minuti mediante meccanismi respiratori (variazioni della ventilazione minuto)
- Nei disturbi respiratori: lenta compensazione (diverse ore o giorni) mediante meccanismi metabolici (modifiche del pH urinario)

Per semplicità la pCO2 attesa in un caso di acidosi metabolica può essere approssimato come gli ultimi due punti del valore decimale in pH (ad esempio, l’atteso pCO2 con un pH di 7,32 è 32 ± 2 mm Hg).
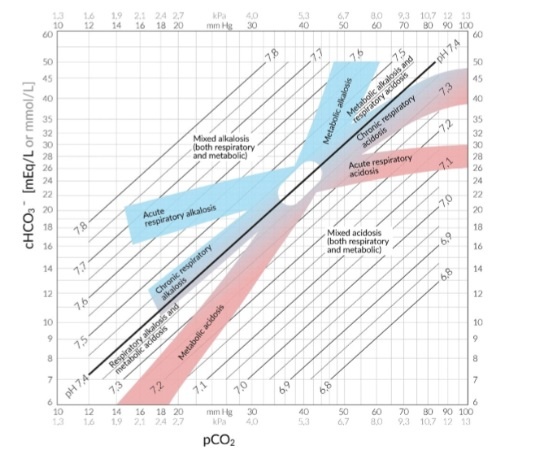
Il cambiamento atteso di HCO3- nei disturbi respiratori acuti può essere ricordato con la regola di 1,2.
- Se il disturbo primario è l’acidosi respiratoria acuta, il bicarbonato aumenta di 1 unità al di sopra di 24 mEq/L per ogni 10 unità di aumento della pCO2 al al di sopra di una linea di base di 40 mm Hg
- Se il disturbo primario è l’alcalosi respiratoria acuta, il bicarbonato diminuisce di 2 unità per ogni 10 unità di riduzione del pCO2dalla linea di base di 40 mm Hg.
Il cambiamento atteso di HCO3- nei disturbi respiratori cronici può essere ricordato con la regola di 4,5:
- Se il disturbo primario è l’acidosi respiratoria cronica, il bicarbonato aumenta di 4 unità da 24 mEq/L per ogni 10 unità di aumento di pCO2 sopra la linea di base di 40 mm Hg
- Se il disturbo primario è l’alcalosi respiratoria cronica, il bicarbonato diminuisce di 5 unità per ogni 10 unità di riduzione del pCO2dalla linea di base di 40 mm Hg.
Gap Anionico
Definizione: differenza tra la concentrazione di anioni non misurati e la concentrazione di cationi non misurati

Interpretazione
Acidosi metabolica con gap anionico normale (acidosi ipercloremica)
- Perdita primaria di HCO3–compensata con ↑ Cl– → gap anionico invariato
Eziologia
- Endogeno: diarrea, fistola biliare o pancreatica, acidosi tubulare renale, malattia di Addison
- Esogeno: farmaci (ad es. Inibitori dell’anidrasi carbonica), assorbimento di acidi contenenti ioni cloruro (ad es. HCl)
Ulteriore valutazione: misurare il gap anionico dell’urina = [Na di urina+] + [urina K+] –
- Divario anionico positivo nelle urine → acidificazione renale (Acidosi tubulare renale)
- Divario negativo nell’anione urinaria → Perdita gastrointestinale di bicarbonato (Diarrea)
Acidosi metabolica con gap anionico elevato
- Aumento della concentrazione di acidi organici come lattato, chetoacidi (beta-idrossibutirrato, acetoacetato), acido ossalico, acido formico o acido glicolico → nessun aumento compensativo di Cl–→ ↑ gap anionico
Eziologia
- Endogeno: acidosi lattica, chetoacidosi, insufficienza renale/uremia
- Esogeno: intossicazione da salicilato, etanolo, metanolo, etilenglicole (componente antigelo prodotti)
Esempi clinici
Esempio 1: in un paziente alcolista con vomito, in condizioni scadute, gli esami di laboratorio mostrano
- Na: 137
- K: 3,8
- Cl: 90
- HCO3−: 22
- pH: 7,40
- pco2: 41
- po2: 85
A prima vista, i risultati appaiono nella norma. Tuttavia, i calcoli mostrano un aumento del gap anionico:
137 − (90 + 22) = 25 (normale, 10-12)
indica un’acidosi metabolica. Il compenso respiratorio è valutato attraverso la formula di Winter:
Pco2 prevista = 1,5 (22) + 8 ± 2 = 41 ± 2
Previsto = misurato, così il compenso respiratorio è appropriato.
Poiché è presente un’acidosi metabolica, si calcola il delta gap e il risultato viene aggiunto all’HCO3− misurato:
25 − 10 = 15
15 + 22 = 37
I valori risultanti di HCO3− corretti sono al di sopra del range di normalità per HCO3−, indicando che è anche presente un’alcalosi metabolica primaria. Così, il paziente ha un disturbo misto acido-base.
Utilizzando le informazioni cliniche, si potrebbe pensare a un’acidosi metabolica sostenuta da una chetoacidosi alcolica combinata con un’alcalosi metabolica da vomito ricorrente con perdita di acido cloridrico (HCl) e di volume.
Altri esempi

Punti chiave
- L’acidosi e l’alcalosi si riferiscono a processi fisiologici che causano accumulo o perdita di acidi e/o alcali; il pH ematico può o non può essere anormale.
- Acidemia e alcalemia si riferiscono a pH sierico con acidità (pH < 7,35) o alcalosi (pH > 7,45) anomala.
- I disturbi acido-base sono classificati come metabolici se le variazioni di pH sono dovute principalmente a un’alterazione nel siero di HCO3− e respiratorio se la variazione è dovuta principalmente alla variazione Pco2 (aumentata o diminuita durante la ventilazione).
- Il pH definisce il processo primario (acidosi o alcalosi), i cambiamenti della pco2 riflettono la componente respiratoria e le variazioni dell’HCO3− riflettono la componente metabolica.
- Tutti i disturbi acido-base provocano compensazione che tende a normalizzare il pH. I disturbi metabolici dell’equilibrio acido-base si traducono in compensazione respiratoria (variazione di pco2); i disturbi respiratori dell’equilibrio acido-base si traducono in compenso metabolico (variazione di HCO3−).
- Può essere presente contemporaneamente più di un disturbo acido-base primario. È importante identificare e inquadrare ogni disturbo acido-base primario.
- La valutazione di laboratorio iniziale delle patologie acido-base comprende la misurazione dei gas ematici e elettroliti sierici e calcolo del gap anionico.
- Utilizzare una delle diverse formule, regole empiriche o un nomogramma acido-base per determinare se i valori di laboratorio sono coerenti con un disturbo singolo acido-base (e compensazione) o se è anche presente una seconda malattia acido-base primaria.
- Trattare ogni disturbo acido-base primario.
Bibliografia
Manuale MSD Merk 2019
Harrison Principi di Medicina Interna 19a edizione