Dettagli
- Definizione
- Epidemiologia
- Clinica
- Istopatologia
- Prognosi
- Eziopatogenesi
- Terapia
- Follow-up
XX.05 – [Capitolo 07] Melanomi cutanei
Definizione
- Il melanoma è fra le neoplasie più maligne nell’uomo e la più maligna in ambito cutaneo. Il melanoma della cute rappresenta la più frequente localizzazione di questo tumore, che trae origine dai melanociti. In particolare, il melanoma può svilupparsi dai melanociti presenti in sede basale epidermica o da cellule melanocitarie particolari (nevociti o cellule neviche di nevi congeniti o acquisiti) o, secondo recenti acquisizioni, da cellule staminali melanoma tose epidermiche, follicolari o dermiche. Il melanoma primitivo nel 15 % circa dei casi origina da melanociti o cellule neviche extracutanee presenti nella vagina, nel canale rettale, nell’esofago, nell’occhio (in particolare congiuntiva e coroide), nei linfonodi, nei bronchi, nella vescica e nelle meningi. Il tumore, se non viene asportato precocemente, metastatizza rapidamente per via linfatica ed ematica; pertanto, è importante effettuare la diagnosi in fase iniziale.
Epidemiologia
- L’incidenza del melanoma è in continuo aumento. In Italia fino agli anni Novanta essa era valutata inferiore a 9-10 casi ogni 100.000 abitanti, mentre successivamente è salita a 11-12 casi ogni 100.000 persone. Presso la Clinica Dermatologica dell’Ospedale di Novara, nell’anno 2012, sono stati operati 104 melanomi primitivi relativi a un bacino d’utenza di circa 300.000 persone. Tale incidenza potrebbe essere anche maggiore considerando il fatto che altri melanomi vengono operati presso altre strutture, tuttavia in questo dato bisogna considerare l’afflusso di pazienti provenienti da altre province. Tale incidenza (oltre 30 casi ogni 100.000 persone) deve comunque far riflettere. Il melanoma rappresenta in Europa il 2-3 % di tutti i tumori maligni (esclusi i carcinomi cutanei) ed è al nono posto tra i tumori maligni nel mondo. L’incidenza è maggiore nel Nord Europa (14 casi ogni 100.000 persone) e minima in Africa (0,5 casi ogni 100.000 persone). La maggiore percentuale di melanomi diagnosticati in fase precoce ha comunque permesso di mantenere costante il dato di mortalità. Il melanoma è più frequente nella quarta e quinta decade di vita ed eccezionale prima della pubertà. L’incidenza nei due sessi è sovrapponibile. Nelle donne la neoplasia si riscontra più frequentemente agli arti inferiori e negli uomini al tronco. Il melanoma è asintomatico spesso anche in fase avanzata. Talora i pazienti hanno solo la percezione di avere una lesione che in precedenza era completamente silente.
Clinica
- Si distinguono clinicamente quattro entità di melanoma, che possono definirsi varianti clinico-evolutive:
- Melanoma piano-superficiale (SSMM, Superficial Spreading Malignant Melanoma) La lesione è inizialmente una macula pigmentata, impalpabile, cui corrisponde la fase di crescita radiale (ossia confinata all’ epidermide e al derma papillare); successivamente, se non asportata, essa può divenire palpabile con tendenza a rilevarsi sul piano cutaneo, cui corrispondono la fase di crescita verticale (ossia esteso coinvolgimento dermico) e l’evoluzione nella forma piano-cupoliforme. Il melanoma ha forma irregolare, asimmetrica e in genere dimensioni superiori a 5-6 mm. I contorni sono spesso indentati e il colore è disomogeneo, con alternanza di aree brune e nerastre; la superficie della neoplasia è indenne (Immagine 01).
- Melanoma cupoliforme o nodulare Si riscontra in circa il 15-20% dei casi e le sue sedi di localizzazione più frequenti sono il dorso, la testa e il collo. La neoplasia ha rapida crescita verticale, senza esser preceduta da una lesione piana (melanoma nodulare d’ emblée). È il melanoma con maggiore tendenza invasiva in profondità, in assenza di apparente fase di crescita radiale, e si presenta come un nodo emisferico a base sessile, raramente peduncolato, delle dimensioni iniziali di un pisello, a rapida crescita; la consistenza è carnosa e il colore varia dal bruno scuro al nero, al bluastro. Talora la superficie è erosa, rossa, finemente granulosa ed emorragica e si ricopre di squamo-croste ematiche (Immagine 02). Il “melanoma nodulare amelanotico” è una rara variante non pigmentata (si veda oltre, Immagine 05).
- Lentigo maligna-melanoma su melanosi di Dubreuilh Si localizza prevalentemente all’estremo cefalico in soggetti anziani e rappresenta il 4-15 % di tutti i melanomi (Immagine 03). Questa varietà clinica di melanoma inizia come una chiazza irregolarmente configurata e pigmentata, che si estende con molta lentezza alla periferia, mantenendo una crescita superficiale. Dopo molti anni la lesione raggiunge dimensioni anche notevoli, ed è lievemente palpabile, di un colore bruno-nerastro, disomogenea, con bordi frastagliati, “a carta geografica”. L’evoluzione è lenta e il decorso è meno aggressivo rispetto agli altri melanomi.
- Melanoma aerale lentigginoso Questo tipo di melanoma di solito origina dalla matrice ungueale, più raramente dal letto o dalla piega ungueale. Talvolta insorge sulla cute palmare o plantare. Le sedi topografiche di localizzazione sono principalmente le dita e soprattutto l’alluce o il pollice. Rappresenta il 5 % di tutti i melanomi. Morfologicamente questa varietà di melanoma inizia sotto forma di macula pigmentaria, a crescita lenta con frequente presenza di aree di regressione. Dopo molto tempo è possibile apprezzare una formazione nodulare a evoluzione ulcerativa. Le lesioni localizzate nell’area della piega ungueale tendono a provocare una diffusione periungueale della pigmentazione (segno di Hutchinson). Solo una biopsia in tali sedi può confermare la diagnosi. La neoplasia, particolarmente aggressiva, è più comune nei soggetti con pelle scura (Immagine 04). Varianti più rare di melanoma sono rappresentate dal melanoma amelanotico in senso stretto, caratterizzato da totale assenza di melanina, e dal melanoma ipomelanotico, in cui sono presenti modeste quantità di melanina. Queste due varietà complessivamente rappresentano il 2-8% di tutti i melanomi maligni e in genere colpiscono zone fotoesposte di pazienti anziani. Dal punto di vista clinico si tratta di macchie, placche o noduli esofìtici, di colore roseo o rosso acceso, talvolta asimmetrici e ulcerati (Immagine 05). La prevenzione del melanoma prevede un’accurata anamnesi e un’attenta valutazione dei suoi precursori del melanoma. Per quanto riguarda l’anamnesi, occorre ricordare che sono più a rischio i soggetti a fototipo chiaro (pelle bianca, occhi azzurri, capelli rossi o biondi, efelidi) con abitudini professionali o hobby caratterizzati da esposizione continuativa o intermittente alle radiazioni ultraviolette (UV), che presentano nevi displastici, familiarità per melanoma e presenza di numerosi nevi (nevomatosi). Sono da considerare precursori tutte le lesioni cutanee che possono rappresentare una potenziale fase evolutiva iniziale del melanoma. Va ancora sottolineato che il melanoma cutaneo trae origine sia da melanociti in sede epidermica o dermica sia da nevi melanocitari, congeniti oppure acquisiti (20-50%) e in particolare, dai cosiddetti nevi atipici. Più rara è l’evoluzione maligna dei nevi dermici e del nevo blu. Per quanto riguarda l’esame obiettivo, sono sospetti i nevi intensamente ipercromici, con pigmento a disposizione molto irregolare, a contorni indentati, alone pigmentato periferico e netta asimmetria; tali lesioni devono essere sottoposte a esame dermatoscopico e, in caso di valutazione dubbia, vanno asportate con esame istologico. L’evoluzione naturale del melanoma è rappresentata da una crescita irregolare (a cui segue l’ulcerazione e talvolta la regressione parziale o totale) e dalla formazione di metastasi. Clinicamente la regressione è caratterizzata da aree ipocromiche (talora bluastre) nel contesto della lesione pigmentata, che conferiscono alla neoplasia aspetti anulari o arciformi. Talvolta la regressione si associa a una modesta atrofia. Il melanoma cutaneo può metastatizzare per contiguità (recidive locali cutanee a meno di 2 cm dalla lesione primitiva, definite metastasi satelliti), per via linfatica (metastasi in transito o ai linfonodi regionali), per via ematogena o più raramente per via perineurale (soprattutto in caso di melanomi localizzati nel distretto testa-collo). Si definiscono metastasi in transit le proliferazioni di noduli neoplastici cutanei e/o sottocutanei lungo il decorso dei vasi linfatici del derma nel segmento cutaneo compreso tra la lesione iniziale e il distretto linfonodale regionale (Figura 14.6). L’interessamento viscerale si ritiene sia dovuto a disseminazione ematica. In caso di metastasi linfonodali o in transito (Nl-3 secondo la stadiazione AJCC [American Joint Committee on Cancer] 2009; si veda la Immagine 02), la sopravvivenza a 5 anni è del 70% se è colpito un solo linfonodo, mentre scende al 39% se sono colpiti quattro o più linfonodi e se sono presenti linfonodi metastatici e metastasi in transito o satelliti. In presenza di metastasi d’organo, la sopravvivenza a 1 anno varia dal 62%, (se sono presenti metastasi cutanee, sottocutanee o nodali a distanza), al 33 % in caso di metastasi viscerali, escluso il polmone; in caso di secondarismi polmonari, si considera una prognosi intermedia. La stadiazione attuale del melanoma, rivisitata dall’ AJCC nel 2009, è riportata nelle Tabella 01 e Immagine 02 e rappresenta l’aggiornamento della precedente stadiazione già pubblicata nel 2001. L’aggressività e, di conseguenza, il giudizio prognostico, vengono valutati in rapporto allo spessore istologico della neoplasia secondo il criterio proposto da Breslow, ossia dello spessore misurato con oculare micrometrico dallo strato granuloso alla profondità massima della neoplasia. Sulla base di studi epidemiologici, la prognosi peggiore, oltre che in funzione dello spessore del melanoma secondo Breslow, si basa su: età avanzata, immunodepressione, livello di Clark superiore al II (si veda più avanti nel testo), melanoma nodulare, fenomeni di regressione, ulcerazione, elevato indice mitotico, invasioni vascolare, linfonodo sentinella positivo e diffusione metastatica agli altri linfonodi riscontrata dopo svuotamento con estensione extracapsulare.
Immagine 01
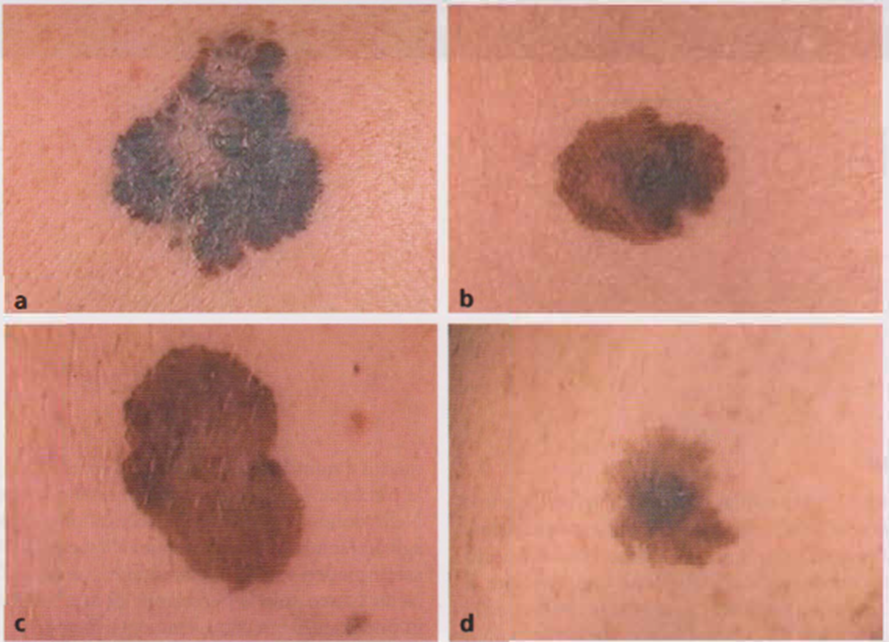
Immagine 01. Varianti cliniche di melanoma piano a diffusione superficiale in fase di crescita radiale confermata istologicamente (melanoma piano-superficiale) localizzate al tronco (a, c) e agli arti (b, d).
Immagine 02
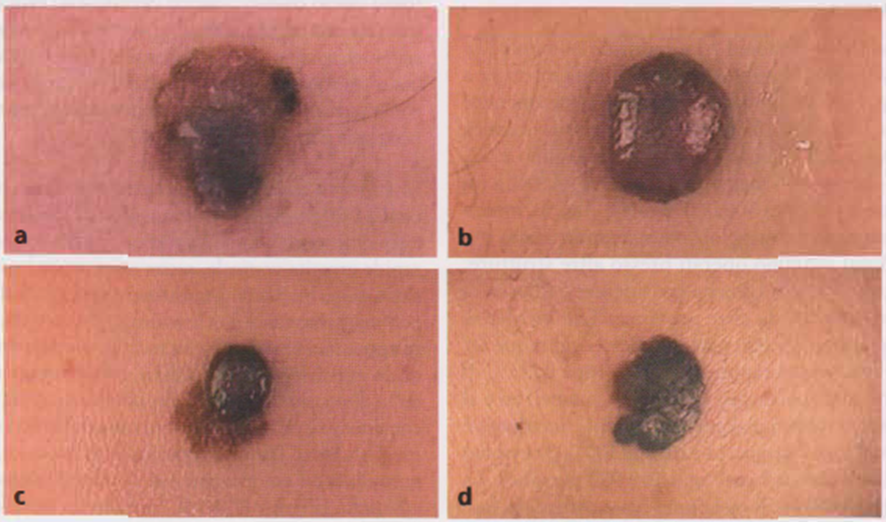
Immagine 02. Varianti cliniche di melanoma nodulare. Si noti in particolare l’evoluzione nodulare all’interno della lesione piana(melanoma piano-cupoliforme) (c).
Immagine 03
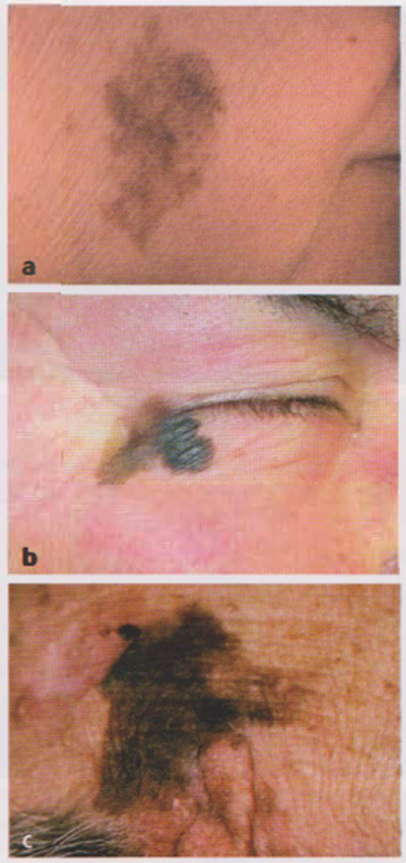
Immagine 03. Melanosi di Dubreuilh del volto confermate istologicamente (a, b) e lentigo maligna-melanoma in regione frontale (e).
Immagine 04
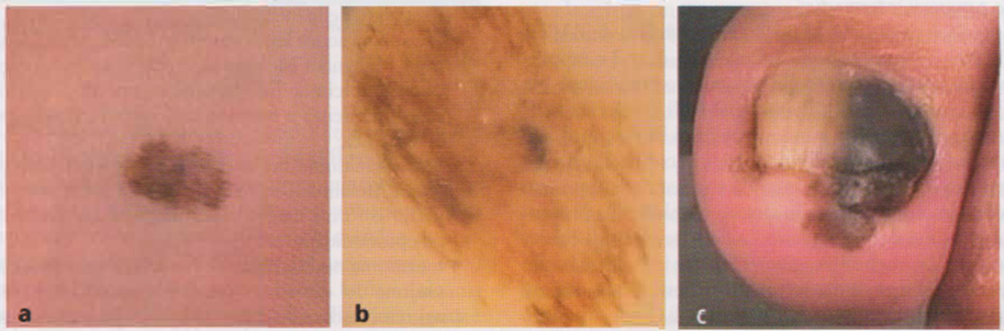
Immagine 04. Aspetto clinico (a) e videodermatoscopico (b) di un melanoma aerale sottile (spessore secondo Breslow <1 mm, Il livello di Clark) e aspetto clinico di un melanoma aerale lentigginoso del primo dito del piede (e).
Immagine 05
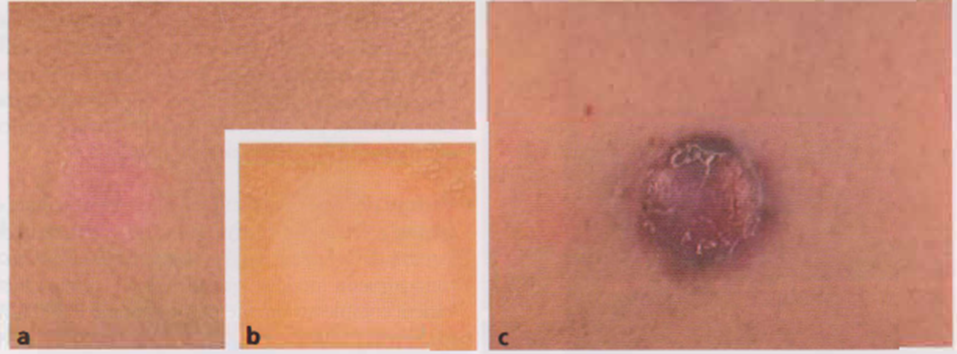
Immagine 05. Aspetto clinico (a) e videodermatoscopico (b) di un melanoma amelanotico piano e aspetto clinico di un melanoma amelanotico nodulare (e).
Istopatologia
- Istologicamente i melanomi vengono suddivisi come segue:
- Melanomi non invasivi (in situ) Quando la neoplasia non supera la membrana basale dermo-epidermica (Immagine 07) e comprendono:
- melanoma non invasivo a diffusione superficiale;
- melanoma non invasivo a tipo di lentigo maligna di Hutchinson-Dubreuilh o melanosi di Dubreuilh (si veda la Immagine 04);
- melanoma non invasivo tipo aerale-lentigginoso.
- Melanomi invasivi (classificazione dell’Organizzazione Mondiale della Sanità) (con fase di crescita radiale e verticale), identificati in base alla presenza e al tipo di componente neoplastica intraepidermica o “spalla” adiacente alla componente invasiva del melanoma che sconfina al di sotto della giunzione dermo-epidemica, i cui sottotipi istologici sono:
- melanoma piano-superficiale (SSMM, Superficial Spreading Malignant Melanoma): presenza di melanociti atipici con disposizione a nidi di cellule tumorali a citoplasma chiaro con distribuzione diffusa e irregolare della melanina;
- melanoma aerale lentigginoso (ALMM, Acral Lentginous Malignant Melanoma): proliferazione di melanociti atipici con lunghi prolungamenti dendritici, scarsa tendenza a formare nidi ed epidermide ipercheratosica;
- lentigo maligna-melanoma (LMM, Lentigo Malignant Melanoma): proliferazione di melanociti atipici, fusiformi, estesa soprattutto lungo gli annessi ed epidermide atrofica;
- melanoma nodulare (NM, Nodular Melanoma): invasione del derma profondo da parte di un clone aggressivo di cellule neoplastiche. La componente dermica è costituita da teche o aggregati di cellule generalmente con scarsa maturazione.
- Melanomi non invasivi (in situ) Quando la neoplasia non supera la membrana basale dermo-epidermica (Immagine 07) e comprendono:
- Di solito si riscontrano con maggiore frequenza cellule epitelioidi nella forma nodulare e a diffusione superficiale, mentre le cellule fusiformi predominano negli altri due istotipi di melanoma. Il melanoma può insorgere su nevo composto o più raramente su nevo dermico, oppure comparire de novo; l’associazione tra melanoma e nevo preesistente non è stata del tutto chiarita. Utile è il ricorso alle tecniche immunoistochimiche sia su lesioni primitive sia su metastasi. Attualmente non sono a disposizione marcatori in grado di differenziare una lesione pigmentaria benigna da una maligna. Tuttavia, alcuni anticorpi monoclonali forniscono informazioni utili in caso di diagnosi differenziale difficile, oppure di identificazione di metastasi di melanoma: S-100, HMB 45, MART 1/ Melan-A, tirosinasi.
Prognosi
- In base alla prognosi i melanomi sono stati distinti in:
- melanoma in situ: il melanoma non supera la membrana basale derma-epidermica. La prognosi è buona dopo exeresi chirurgica con quasi il 100% di sopravvivenza a 10 anni;
- melanoma sottile: quando lo spessore secondo Breslow è inferiore a 1 mm di profondità. La sopravvivenza è pari al 95 ,3 % a 5 anni e all’87 ,9% a 10 anni in assenza di ulcerazione;
- melanoma spesso: ossia con spessore secondo Breslow maggiore di 1 mm. La prognosi peggiora proporzionalmente ali’ aumentare dello spessore istologico, non considerando però gli altri fattori prognostici, ma solo lo spessore. In caso di spessore di 1-2 mm, la sopravvivenza a5 anni è pari all’89% e a 10 anni al 79,2%; tuttavia, con spessore di 2-4 mm la sopravvivenza scende, rispettivamente, al 78,7% e al 63,8%. In caso di spessore superiore a 4 mm si osserva un tasso di sopravvivenza del 67,4% e del 57,9%.
- L’indice mitotico, ossia il numero di mitosi per millimetro quadrato del melanoma primitivo e l’ulcerazione sono considerati i fattori prognostici più importanti dopo lo spessore secondo Breslow.
- Un altro parametro di valutazione si basa sul grado di invasione del melanoma in profondità (nel derma e ipoderma) secondo i livelli proposti da Clark. Il I livello corrisponde al melanoma in situ, il II a in infiltrazione parziale del derma papillare, il III a una invasione massiva del derma papillare, il IV a invasione del derma reticolare e il V a invasione dell’ipoderma.
- Il linfonodo sentinella è la prima sede linfonodale del drenaggio linfatico dell’area di escissione del melanoma primitivo. Si effettua l’asportazione del linfonodo sentinella in caso di exeresi di melanomi con spessore maggiore di 1 mm secondo Breslow, indice mitotico maggiore o uguale a 1 per millimetro quadrato o ulcerazione, ossia melanomi Tlb, T2, T3, T4, stadiati con esami strumentali e liberi da malattia a distanza. In caso di presenza di cellule melanomatose nel linfonodo sentinella, si procede alla linfoadenectomia radicale della stazione coinvolta. La tecnica si avvale della linfoscintigrafia dopo iniezione intradermica, in prossimità della lesione melanomatosa o intorno alla cicatrice di exeresi della stessa, ai quattro punti cardinali, di un tracciante radioattivo y-emittente (99mTc albumina umana marcata). Il bacino (o i bacini) di drenaggio linfatico, all’interno del quale è presente il linfonodo sentinella, vengono individuati con gammacamera. In sala operatoria, il linfonodo, dopo ulteriore iniezione nelle stesse sedi di un colorante vitale, al fine di aumentare la sensibilità della procedura chirurgica, viene riconosciuto e asportato utilizzando una sonda in grado di misurare la radioattività accumulata nel nodo in associazione alla sua colorazione. La metodica di esame istologico è talmente sensibile da permettere l’individuazione non solo delle micro metastasi ma anche delle cosiddette “cellule tumorali isolate”. Tutti gli studi hanno dimostrato che la biopsia del linfonodo sentinella è una tecnica altamente sensibile e che lo stato del linfonodo sentinella è un fattore prognostico significativo rispetto alla sopravvivenza.
- La sopravvivenza globale dei pazienti con linfonodo sentinella negativo è a 5 anni nelle principali casistiche del 90-92% circa; essa scende al 70% circa con linfonodo sentinella positivo.
Tabella 01
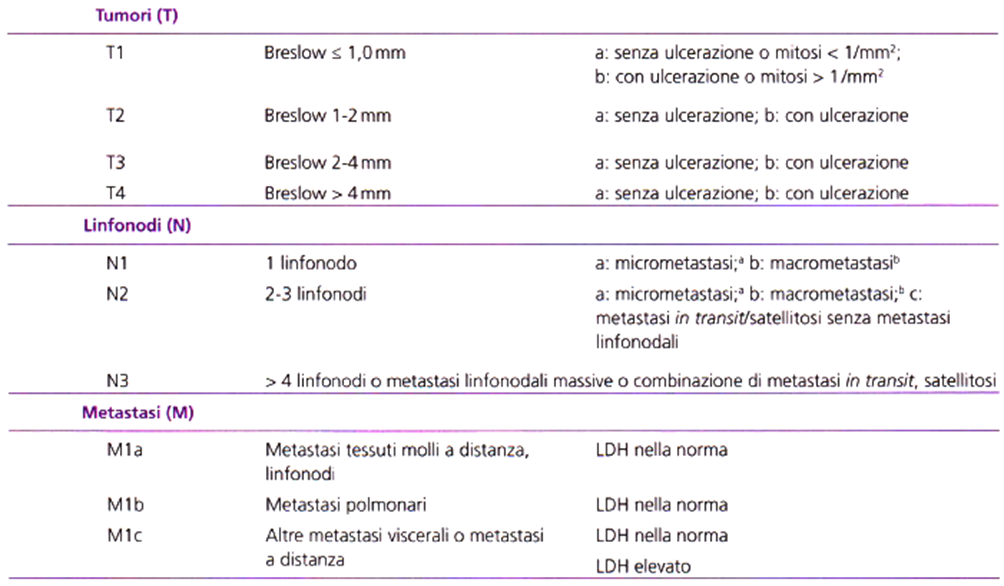
Tabella 01. Classificazione TNM del melanoma cutaneo (AJCC 2009). AJCC, American Joint Committee on Cancer Da Ba/eh et al., Fina l Version of 2009 AJCC Melanoma Staging and Classification, J Clin Oncol, 2009, 27-6199-6206. a Dopo biopsia dellinfonodo sentinella o linfoadenectomia elettiva. b Metastasi linfonodali clinicamente pa/pabi/i e confermate dopo linfoadenectomia o metastasi linfonodali associate a superamento capsulare. LDH (Lactate Dehydrogenase), lattato deidrogenasi.
Immagine 06
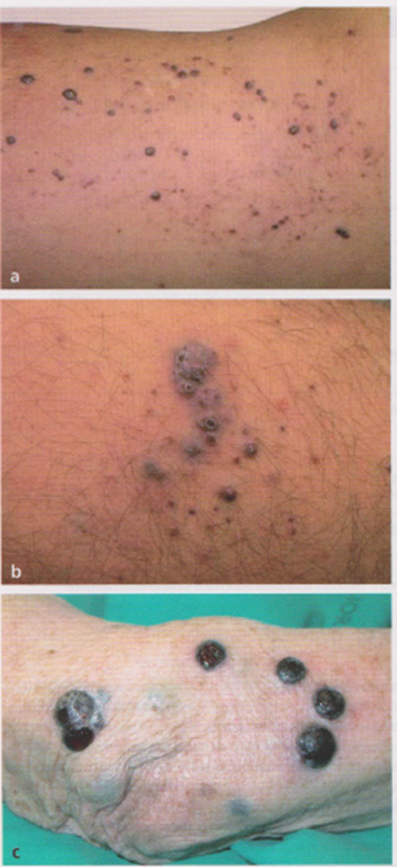
Immagine 06. Metastasi cutanee diffuse di melanoma agli arti in differenti stadi.
Immagine 07
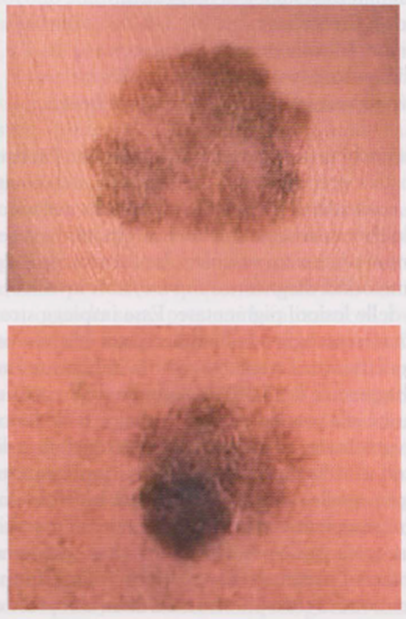
Immagine 07. Aspetti clinici di mela nomi in situ.
Eziopatogenesi
Fattori endogeni
- L’importanza della predisposizione genetica è dimostrata dai casi familiari di melanoma e dalla evenienza di melanomi multipli nello stesso soggetto (8-9% dei melanomi). Circa il 10% dei pazienti ha almeno un familiare di primo e/o secondo grado con melanoma, indipendentemente dall’associazione con la sindrome del nevo displastico. Quest’ultima condizione, descritta da Clark nel 1978, è caratterizzata da nevi displastici multipli e può essere sporadica o familiare (trasmissione autosomica dominante a penetranza variabile con possibile associazione di melanomi familiari). Mutazioni geniche sono riscontrate nei cromosomi 6 e 9. Il gene p21 (CDKN2A), sito in quest’ultimo cromosoma, codifica la proteina P16, che è un oncosoppressore. Sono in corso studi atti a individuare i fattori genetici predisponenti al melanoma sporadico e rivolti allo studio dei polimorfismi di geni che influenzano il fototipo del paziente (MClR recettore per – MSH [Melanocyte Stimulating Hormone, ormone di stimolazione dei melanociti], EGF [Epidermal Growth Factor, fattore di crescita epidermico]). Tra i fattori endogeni, particolare importanza riveste, come per i carcinomi cutanei, anche l’assetto immunologico del paziente.
Fattori esogeni
- Le cause elicitanti sono rappresentate da fattori ambientali, soprattutto dai raggi UV (radiazioni solari ma anche quelle emesse da lettini e lampade abbronzanti, soprattutto per la fascia di età inferiore ai 35 anni), in soggetti che nel corso della vita si espongono a irradiazioni eccessive. La comparsa di melanoma a diffusione superficiale pare associata a esposizione intermittente agli UV (particolare importanza al dato anamnestico di ustioni solari in età pediatrica), mentre l’esposizione continuativa sembrerebbe provocare la lentigo maligna-melanoma. Il melanoma nodulare d’emblée insorgerebbe indipendentemente dall’esposizione agli UV, soprattutto in soggetti con pochi nevi melanocitari. D’altronde, il numero dei nevi presenti sulla cute è tra i più importanti fattori predisponenti al melanoma, in quanto è stato calcolato che circa 1 nevo su 7000 si trasforma in melanoma.
CRITERI DIAGNOSTICI E DIAGNOSI DIFFERENZIALE
- La diagnosi di melanoma è di regola complessa e nelle fasi iniziali molto difficile. Di fronte a una lesione pigmentaria a comparsa improvvisa (in soggetti oltre i 25 anni), oppure a una lesione nevica congenita o acquisita che si estende e va incontro a modificazioni di volume o a variazione dei suoi caratteri morfologici, appare particolarmente importante conoscere i cosiddetti segni di allarme, che suggeriscono l’asportazione precoce della lesione sospetta con relativo esame istologico. Il sospetto di lesione evolutiva si fonda su alcune modificazioni che awengono in pochi mesi. A scopo mnemonico, tali segni clinici sono riassunti dalla sigla ABCDE, dalle iniziali dei caratteri indice di malignità:
- A: asimmetria (sugli assi maggiori);
- B: bordi (irregolari);
- C: colore (disomogeneo);
- D: dimensioni (> 6 mm);
- E: evoluzione (della lesione in tempi brevi).
- La dermoscopia ha notevolmente migliorato l’accuratezza diagnostica preoperatoria delle lesioni melanocitarie e spesso consente di escludere lesioni non melanocitarie, come le cheratosi seborroiche, i carcinomi basocellulari pigmentati e le lesioni vascolari. La dermoscopia, quindi, è una metodica diagnostica in vivo, non invasiva, per lo studio delle lesioni pigmentate. Essa impiega strumenti come la microscopia a epiluminescenza e la microscopia a luce polarizzata. La tecnica sembra migliorare l’accuratezza diagnostica del 5-30% a seconda delle casistiche, se comparata alla sola osservazione clinica delle lesioni cutanee pigmentate, ed è associata a una sensibilità diagnostica pari al 90%. Si definiscono caratteri (pattern) dermoscopici quelle strutture specifiche e individualizzabili che ogni singola lesione può presentare all’osservazione dermoscopica. Sono predittivi per la diagnosi di melanoma cutaneo il riscontro di un pattern polimorfo (ossia la combinazione di tre o più strutture dermoscopiche distinte) e la presenza dei seguenti criteri dermoscopici locali:
- strie e pseudopodi (strutture lineari di colore marrone-nerastro di spessore variabile) alla periferia della lesione;
- velo bianco-bluastro (pigmentazione diffusa confluente di colore dal grigio-blu al blu biancastro) spesso indistinguibile dalle strutture di regressione (aree bianche o blu o in combinazione, anch’esse tipiche del melanoma);
- punti, globuli e reticolo irregolare, presenza di vasi lineari irregolari, puntiformi e a forcina o pattern vascolare polimorfo (Immagine 09).
- L’esame dermoscopico può essere utile a fini diagnostici per il melanoma amelanotico o ipomelanotico, con valutazione del pattern vascolare; la sensibilità diagnostica in questo caso particolare è pari al 65-75% (inferiore a quella per lesioni pigmentate).
- La diagnosi differenziale del melanoma si pone con lesioni piane o nodulari pigmentate e, in particolare, con nevi melanocitari e non ipercromici, cheratosi seborroiche pigmentate, carcinoma basocellulare pigmentato, Angioma tuberoso, angiocheratoma, emorragie dermoepidermiche e sottoungueali, istiocitorna fibroso pigmentato. La diagnosi di melanoma amelanotico, ossia non pigmentato, non è facile. In diagnosi differenziale vanno considerate entità infiammatorie come granulomi piogenici, ma anche i morbi di Paget e di Bowen, il cheratoacantoma e l’emangioma. Uno dei problemi più difficili da risolvere clinicamente riguarda la diagnosi differenziale nei confronti di nevi melanocitari di aspetto atipico o che presentano parametri sospetti per evoluzione melanomatosa all’esame dermoscopico. In ogni caso, è sempre necessario chiedere al paziente se il melanoma è stato preceduto da un nevo (Immagine 10). Ovviamente ogni lesione dubbia deve essere asportata e sottoposta a esame istologico. Non esiste consenso in letteratura su quali siano gli esami da effettuare al momento della diagnosi. Si consiglia di eseguire sempre esami ematici associati a ecografia dell’addome superiore e inferiore, delle stazioni linfonodali satelliti e una radiografia del torace per melanomi “sottili” o una tomografia computerizzata (TC) total body con mezzo di contrasto per melanomi con elevato rischio di metastasi (sulla base dei fattori prognostici appena citati).
Immagine 08
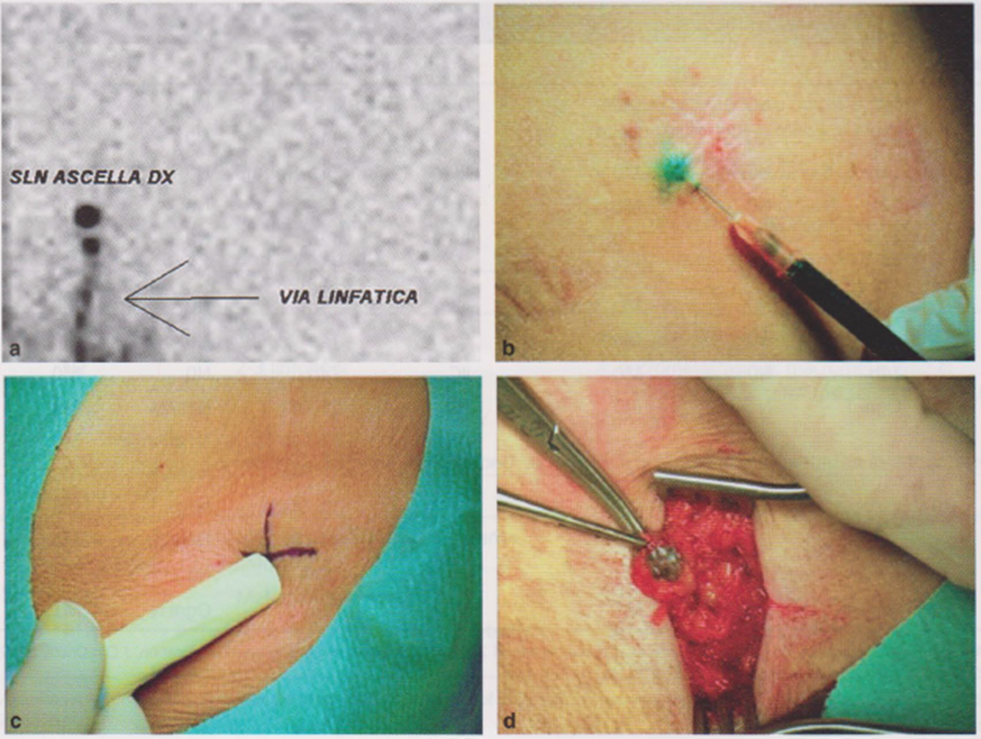
Immagine 08. Evidenziazione alla linfoscintigrafia dellinfonodo sentinella (a), iniezione di mezzo di contrasto (b) e asportazione (c, d).
Immagine 09
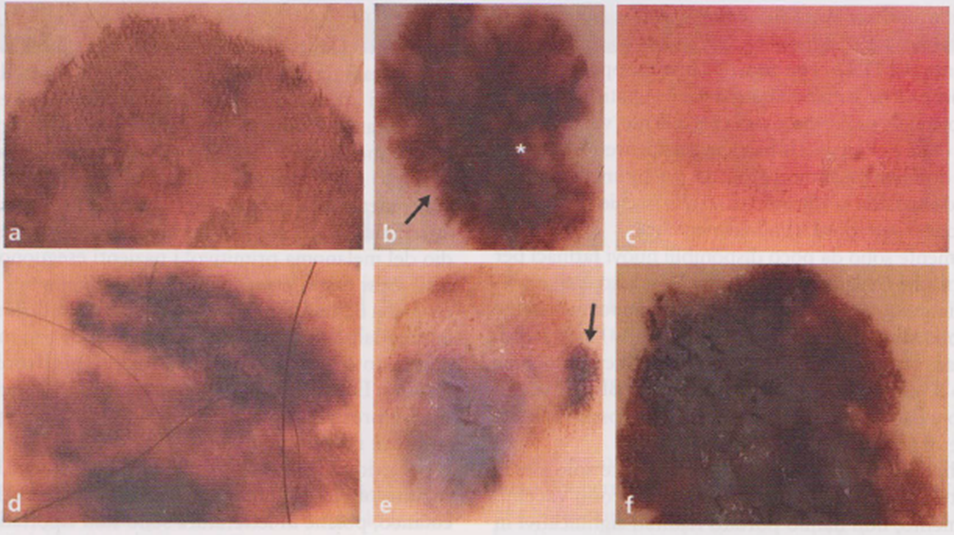
Immagine 09. Pattern dermoscopici tipici di melanoma cutaneo. Pattern reticolare atipico (a) e velo bluastro centrale (asterisco) e strie periferiche (freccia) (b). Pattern vascolare polimorfo (vasi a virgola, puntiformi, a forcina e lineari irregolari) (c) e pattern reticolare atipico (d). Pattern polimorfo con pseudopodi al polo laterale (freccia) (e) e area bluastra di regressione al centro della lesione (f).
Immagine 10
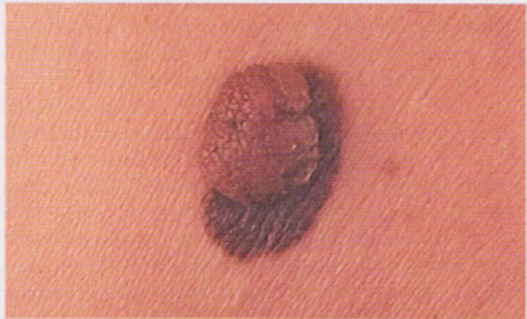
Immagine 10. Melanoma insorto in associazione a neve dermico polipoide.
Tabella 02
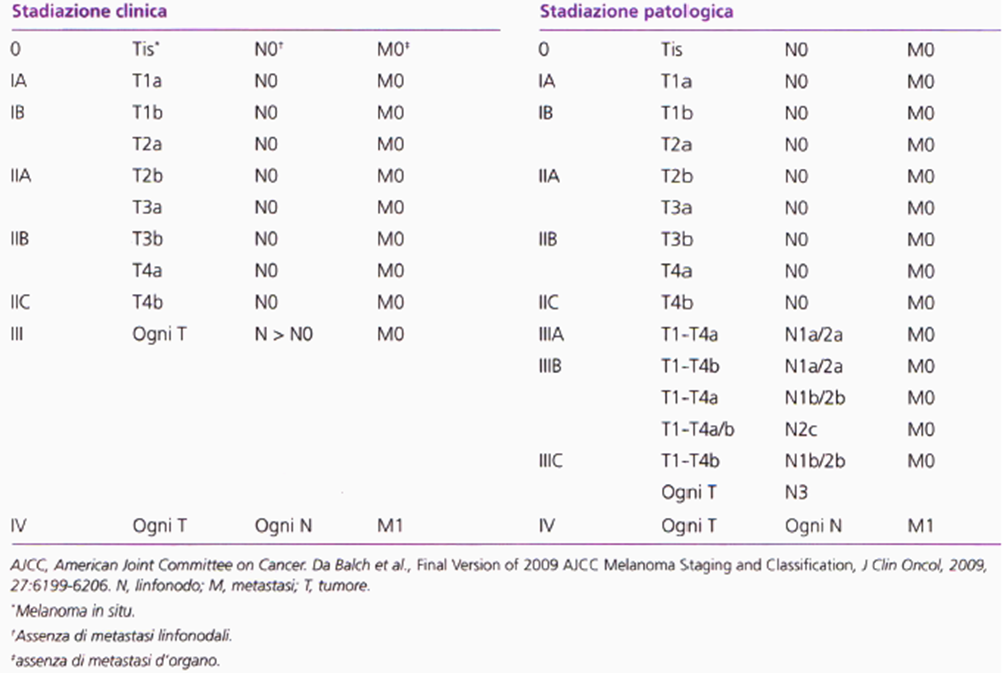
Tabella 02. Stadiazione del melanoma cutaneo (AJCC 2009).
Terapia
- La terapia deve essere chirurgica ed eseguita quanto più precocemente possibile. L’escissione chirurgica viene effettuata a 2-3 mm dai bordi visibili, per non alterare troppo il deflusso linfatico della sede di intervento, al fìne di eseguire in un secondo tempo, ove richiesto, la biopsia del linfonodo sentinella. In base al referto istologico e in particolare allo spessore secondo Breslow, si procede all’eventuale allargamento dell’escissione convenzionale. Il protocollo standardizzato prevede escissione del melanoma primitivo a 0,5-1 cm dal margine del melanoma in situ, a 1 cm per melanoma di spessore minore di 2 mm e a 2-3 cm per melanoma con spessore maggiore di 2 mm. L’escissione deve sempre comprendere un’ampia area di tessuto ipodermico fino al piano fasciale escluso. È stato dimostrato che escissioni più vaste non migliorano la prognosi.
- Il trattamento di prima scelta per le metastasi cutanee loco-regionali è rappresentato dall’escissione chirurgica. Altre opzioni, riservate a centri specializzati, sono rappresentate dalla perfusione ipertermica antiblastica isolata dell’arto, quando sono presenti localizzazioni multiple agli arti inferiori (melphalan ad alte dosi dopo isolamento circolatorio dell’arto e riscaldamento dello stesso), e dall’ elettrochemioterapia, in quanto l’elettroporazione aumenta l’assorbimento di cisplatino e bleomicina somministrati per via sistemica o intralesionale. Le metastasi loco-regionali linfonodali vengono sottoposte a linfoadenectomia radicale. Le metastasi d’organo vengono sempre asportate, quando possibile; in caso di metastasi diffuse si ricorre a chemioterapia (dacarbazina, temozolamide, nitrosuree, cisplatino) o a immunochemioterapia (IFN-α e IL [interleuchina]-2 in associazione con gli altri chemioterapici). A differenza di altre neoplasie maligne, il melanoma evidenzia scarsa risposta alla mono- e alla polichemioterapia. Il farmaco più utilizzato è stata la dacarbazina, agente alchilante del DNA, che provoca mielosoppressione ad alte dosi e viene metabolizzato a livello epatico; anche la temozolamide, profarmaco della precedente, viene assunta per via orale e oltrepassa la barriera ematoencefalica. L’IFN ad alte dosi non migliora la prognosi e neppure l’intervallo libero da malattia nei melanomi ad alto rischio di metastatizzazione o sottoposti a linfoadenectomia.
- Attualmente sono da poco disponibili nuovi farmaci per la terapia del melanoma metastatico (cosiddetta target therapy e immunoterapia): da un lato Ab monoclonali come l’ipilimumab (Ab monoclonale anti-CTLA4) in grado di stimolare una risposta immunitaria specifica linfocitica contro il tumore; dall’altro gli inibitori di BRAF (vemurafenib e dabrafenib) o Mek (trametinib), ossia delle vie mutate di replicazione cellulare.
- La radioterapia trova utilizzo praticamente solo per le metastasi cerebrali. Le sperimentazioni con i vaccini, al momento, non hanno portato risultati significativi in termini di sopravvivenza rispetto alla chemioterapia.
Follow-up
- I pazienti operati di melanoma di solito vengono inseriti in un programma di follow-up, che prevede controlli clinici periodici atti a individuare recidive su cicatrice, metastasi cutanee e/o sottocutanee ed eventuale insorgenza di altri melanomi (il 5 % circa dei pazienti ha melanomi multipli) e l’esecuzione di esami strumentali per individuare metastasi d’organo o linfonodali. Pur non esistendo linee guida internazionali univoche, a seconda dello stadio del melanoma primitivo, i pazienti eseguono ogni 6 e 12 mesi esami ematochimici, radiografia del torace, ecografia dell’addome superiore e inferiore e delle stazioni linfonodali satellite, oppure TC tota! body con mezzo di contrasto o tomografia a emissione di positroni (PET, Positron Emission Tomography) tota! body. La scintigrafia ossea è prescritta solo in caso di sintomatologia specifica (fratture non traumatiche, algie diffuse o localizzate). Il periodo di osservazione del paziente dovrebbe proseguire oltre i 10 anni dall’asportazione di melanoma cutaneo, poiché in letteratura sono stati riportati casi di metastasi dopo decenni.