Dettagli
- Definizione
- Epidemiologia
- Eziologia e patogenesi
- Anamnesi ed esame obiettivo
- Diagnosi
- Terapia
- Immagine 01
- Immagine 02
- Immagine 03
05.08 – [05.03 – Infezioni batteriche] Sindrome da shock tossico (toxic shock syndrome, TSS)
Definizione
- La sindrome da shock tossico stafilococcico (STSS) si riferisce a una malattia sistemica grave, ad insorgenza improvvisa, causata da un’infezione o una colonizzazione con ceppi di Staphylococcus aureus cheproducono tossine. I casi di STSS possono essere legati al ciclo mestruale o possono sorgere nel contesto di altre infezioni.
- Tra le varianti collegate al ciclo mestruale sappiamo che gli episodi acuti si verificano entro 2-3 giorni dall’inizio del flusso. Il 95% dei casi di sindrome da shock tossico mestruale (TSS) sono associati all’infezione vaginale da Staphylococcus aureus, mentre il restante 5% dei casi è associato ad altri siti di infezione. Tra le possibili causa ritroviamo l’uso degli assorbenti interni, che introducono l’ossigeno necessario per la produzione di tossine. L’incidenza è diminuita con il ritiro delle vendite di tamponi altamente assorbenti e contenenti rayon poliacrilato e la mortalità è diminuita dal 5,5% nel 1979-1980 all’1,8% nel 1987-1996.
- Nei casi “non mestruali” esistono una varietà di situazioni cliniche tra cui: infezioni di ferite chirurgiche, postpartum e dei tessuti molli, infezioni del sito di ustioni, sinusiti ed infezioni respiratorie post influenza. Nei bambini, circa la metà dei casi si verifica sotto i 2 anni e la maggior parte è associata a lesioni cutanee non chirurgiche. Il tasso di mortalità globale è del 5%.
Epidemiologia
- L’ incidenza media annuale della sindrome da shock tossico da stafilococco è di 0,52 casi per 100.000 persone in Minnesota, nel 2000-2006.
Eziologia e patogenesi
- I primi responsabili sono i ceppi di Staphylococcus aureus produttori di tossine. Il 7% dei casi è dovuto a ceppi resistenti alla meticillina (secondo uno studio in Minnesota del 2000-2006). La produzione di tossine varia tra i ceppi isolati dei casi mestruali e non mestruali.
- La sindrome da shock tossico da streptococco è un’entità clinica distinta causata dall’infezione da Streptococco di gruppo A.
- La sindrome da shock tossico da stafilococco si verifica in seguito a un’infezione localizzata o a una colonizzazione con Staphylococcus aureus produttore di esotossine dovuta a: ascessi, bruciature, infezioni cutanee e sottocutanee, infezioni respiratorie, siti chirurgici, infezioni articolari oppure da fonte non ben identificata.
- Le esotossine sono membre della famiglia dei superantigeni. Tra di esse sono state identificate 24 sottotipi tra cui: la tossina-1 della sindrome da shock tossico (TSST-1), sierotipi di enterotossine stafilococciche (SE) e superantigeni simili a SE. I singoli ceppi possono produrre da 1 a 23 esotossine. Queste sono sostanze altamente stabili, con resistenza al calore, all’acido, alla proteolisi e all’essiccazione. Tutti i superantigeni SE hanno attività emetica, anche se TSST-1 e tutti i superantigeni SE-simili testati non ne hanno. La produzione di esotossine richiede un ambiente aerobico e un pH neutro.
- La produzione di TSST-1 e di enterotossine avvia una cascata di eventi tossici. TSST-1 e le esotossine agiscono come superantigeni per interrompere l’immunomodulazione. I superantigeni interagiscono con le cellule T e le cellule presentanti l’antigene e ciò induce la proliferazione delle cellule T e la produzione incontrollata di citochine. In contrasto con l’attivazione convenzionale dell’antigene dello 0,01% della popolazione delle cellule T, i superantigeni inducono l’attivazione del 20%-30% delle cellule T circolanti. L’aumento dell’espressione delle citochine da parte delle cellule T porta all’iperattivazione di NFkappaB, che porta a: adesione e l’attivazione dei neutrofili e quindi a danno endoteliale; diminuzione della fibrinolisi e aumento della coagulazione, causando una trombosi microvascolare; diminuzione della gittata cardiaca, ipotensione e danni ai tessuti ed infine aumento dell’ossido nitrico, vasodilatazione e ipotensione.
- In letteratura esistono anche rari casi di sindrome da shock tossico dopo la colonizzazione di Staphylococcus aureus delle ferite da ustione nei bambini. La rinosinusite è stata identificata come fonte presuntiva di infezione nel 21% dei pazienti pediatrici con diagnosi di sindrome da shock tossico.
Anamnesi ed esame obiettivo
- I segni e i sintomi tipici includono: febbre > 38,9 gradi, eruzione eritematosa, simile a una scottatura, mal di testa, vomito e diarrea (spesso sintomi precoci dovuti all’effetto della tossina sul tratto gastrointestinale), mialgie (anche gravi), letargia e confusione. Lo shock e l’insufficienza multiorgano possono verificarsi già 8-12 ore dopo l’inizio dei sintomi oppure come debutto della malattia.
- Le infezioni da Staphylococcus aureus sono più frequenti all’inizio delle mestruazioni quando il microambiente vaginale favorisce la produzione di tossine (il picco è intorno al terzo-quarto giorno di flusso). Il pH vaginale neutro durante le mestruazioni crea un ambiente favorevole alla produzione di esotossine e si presume che i tamponi interni introducano ossigeno nell’ambiente vaginale. Le donne che sviluppano la sindrome da shock tossico mestruale in genere non hanno anticorpi contro le esotossine stafilococciche e sono a rischio di episodi ripetuti della malattia. I casi “non mestruali” possono essere associati a un tempo più lungo dall’esposizione all’insorgenza dei sintomi, a uno sviluppo più rapido degli stessi o a tassi maggiori di acquisizione nosocomiale rispetto alle pazienti con sindrome da shock tossico mestruale.
- I sintomi generali includono: febbre (spesso sopra i 38,9 gradi C), ipotensione e stato mentale alterato. Va ricercata anche la lesione o la regione sospettata come fonte di infezione o colonizzazione da Staphylococcus aureus.
- Sulla pelle l’eruzione cutanea è caratteristica della sindrome da shock tossico. L’eritroderma maculare diffuso assomiglia alle scottature solari e si sviluppa entro poche ore dall’inizio dei sintomi, anche se una sottile eruzione eritematosa maculopapulare può svilupparsi più tardi nel corso della malattia acuta. La desquamazione della pelle delle mani e dei piedi segue tipicamente 10-21 giorni dopo l’inizio della malattia; essa include palmi, piante dei piedi e dita delle mani e dei piedi. I segni focali dell’infezione post-chirurgica delle ferite possono apparire, anche se rari, nei pazienti con sindrome da shock tossico post-chirurgico non mestruale.
- L’esame ORL serve per valutare l’iperemia congiuntivale ed orofaringea.
- Nei casi di sospetta sindrome da shock tossico mestruale l’esame genitourinario deve includere l’ispezione vaginale, la rimozione di qualsiasi prodotto catameniale e la raccolta di tamponi vaginali e cervicali per cultura e microscopia.
Diagnosi
- Nel 2011 i “Centers for Disease Control and Prevention (CDC)” hanno stabilito la definizione di caso per la sindrome da shock tossico (diversa da quella streptococcica). I criteri clinici includono: febbre ≥ 38,9 gradi C, eritroderma maculare diffuso, desquamazione (in particolare sui palmi delle mani e sulle piante dei piedi 1-2 settimane dopo la comparsa dell’eruzione) ed ipotensione (pressione sistolica ≤ 90 mm Hg negli adulti e meno del quinto percentile nei bambini sotto i 16 anni).
- Un ulteriore criterio consiste nel coinvolgimento multisistemico che include ≥ 3 tra diversi apparati. Ad esempio: un coinvolgimento gastrointestinale, con vomito o diarrea all’inizio della malattia; un coinvolgimento muscolare, con grave mialgia o creatina fosfochinasi ≥ due volte il limite superiore del normale; un coinvolgimento delle mucose, con iperemia vaginale, orofaringea o congiuntivale; un coinvolgimento renale, con azoto ureico nel sangue o creatinina almeno due volte il limite superiore della norma; un sedimento urinario con piuria (≥ 5 leucociti per campo ad alta potenza) in assenza di infezione del tratto urinario; un coinvolgimento epatico, con alanina aminotransferasi, aspartato aminotransferasi o bilirubina totale almeno due volte il limite superiore della gamma normale per gruppo di età; un coinvolgimento ematologico, con conta delle piastrine ≤ 100.000/mm3; un coinvolgimento del sistema nervoso centrale, con disorientamento o coscienza alterata senza segni neurologici focali in assenza di febbre e ipotensione.
- I criteri di laboratorio includono culture del sangue o del liquido cerebrospinale negative (possono essere positive per lo Staphylococcus aureus) e sierologie negative per la febbre maculata delle Montagne Rocciose, la leptospirosi e il morbillo. I casi probabili sono quelli che soddisfano i criteri di laboratorio e 4 dei 5 criteri clinici. I casi confermati sono quelli che soddisfano i criteri di laboratorio e tutti e 5 i criteri clinici compresa la desquamazione (a meno che il paziente muoia prima della desquamazione).
- Per quanto riguarda i test paraclinici l’approccio iniziale è simile a quello per la sepsi e può includere: esami del sangue di routine (emocromo completo, pannello metabolico completo di elettroliti, glucosio, test di funzionalità epatica ed albumina), LDH, emogas, studio della coagulazione, amilasi e lipasi. I test microbiologici comprendono l’analisi con cultura delle urine e dell’espettorato con colorazione di Gram per coloro che hanno segni o sintomi respiratori. I campioni vengono raccolti dalle possibili fonti di colonizzazione o infezione da Staphylococcus aureus come l’orofaringe, la mucosa vaginale e le ferite chirurgiche o postpartum.
Terapia
- Non esistono studi randomizzati o linee guida basate sull’evidenza che definiscano il regime di trattamento. L’organismo causale in genere non è noto nelle fasi iniziali e la gestione è simile a quella per lo shock settico con particolare attenzione a: idratazione aggressiva ed uso di agenti vasopressori o inotropi, se appropriato; antibiotici ad ampio spettro; ventilazione meccanica o terapia di sostituzione renale; accurata indagine per qualsiasi infezione che possa richiedere un controllo urgente alla fonte.
- Il controllo della fonte include la rimozione della causa potenziale (prodotti catameniali, tessuto infetto o ascesso) e campioni di microscopia e coltura se applicabili. Se si sospetta uno shock tossico mestruale si deve rimuovere immediatamente i prodotti catameniali e raccogliere campioni di microscopia e cultura dal tratto genitale inferiore. Se si sospetta una sindrome da shock tossico (TSS) non mestruale bisogna raccogliere campioni di microscopia e cultura da aree di possibile infezione o colonizzazione. Una volta identificata la causa infettiva si agisce d’urgenza tramite sbrigliamento del tessuto infetto ed eventuale drenaggio di ascessi.
- Nel forte sospetto di uno shock tossico da stafilococco, il regime antibiotico empirico dovrebbe includere la clindamicina 600-900 mg IV ogni 8 ore negli adulti oppure 25-40 mg/kg/giorno in 3 o 4 dosi equamente divise. In alternativa si può considerare un agente che prende di mira lo Staphylococcus aureus resistente alla meticillina (MRSA), come la vancomicina 15-20 mg/kg IV ogni 8-12 ore per adulti con funzione renale normale (non superare i 2 g per dose), oppure 15 mg/kg IV ogni 6 ore nei bambini. Il linezolid può essere una ragionevole alternativa alla vancomicina.
- La terapia definitiva dovrebbe essere basata sulla suscettibilità dell’isolato (se in cultura) e sul sito di infezione o colonizzazione. Non esistono prove dirette identificate sulla terapia antibiotica definitiva preferita per la TSS stafilococcica, ma un approccio comune è quello di utilizzare un agente di prima linea per il trattamento della batteriemia da stafilococco (come la nafcillina 2 g IV ogni 4 ore, l’ oxacillina 2 g IV ogni 4 ore per ceppi sensibili alla meticillina o la vancomicina per i ceppi resistenti alla meticillina). In aggiunta si associa la clindamicina (un inibitore della sintesi proteica aggiunto per la sua potenziale capacità di sopprimere la produzione di tossine).
- L’aggiunta di immunoglobuline IV è spesso suggerita, ma i dati di supporto sono limitati all’estrapolazione da studi sulla sindrome da shock tossico da streptococco e ai dati in vitro. L’uso della terapia corticosteroidea è controverso.
Immagine 01
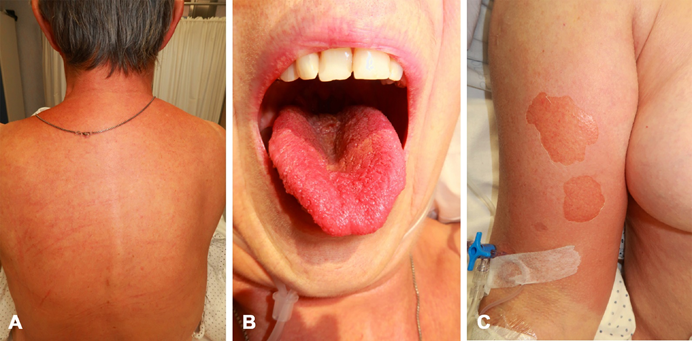
Immagine 01. Coinvolgimento sistemico del dorso (A), lingua (B) e braccio (C) nello shock tossico da Stafilococco.
Immagine 02
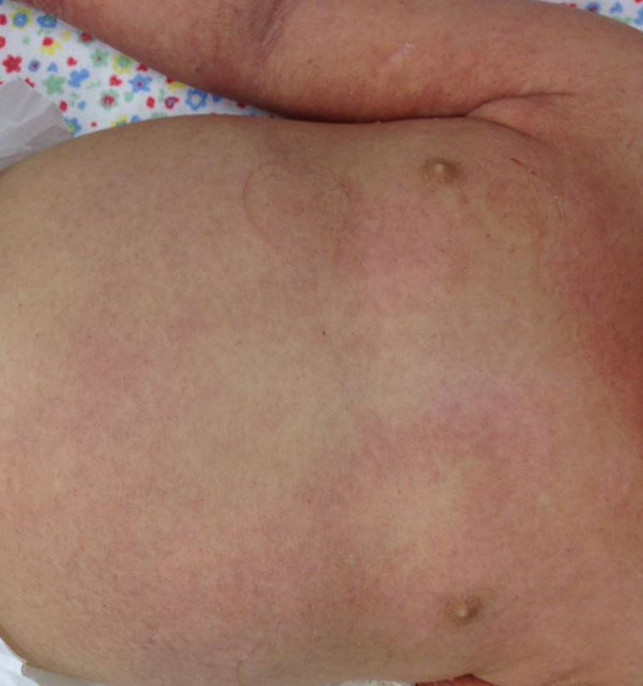
Immagine 02. Rash cutaneo su torace ed addome nello shock tossico in paziente pediatrico.
Immagine 03
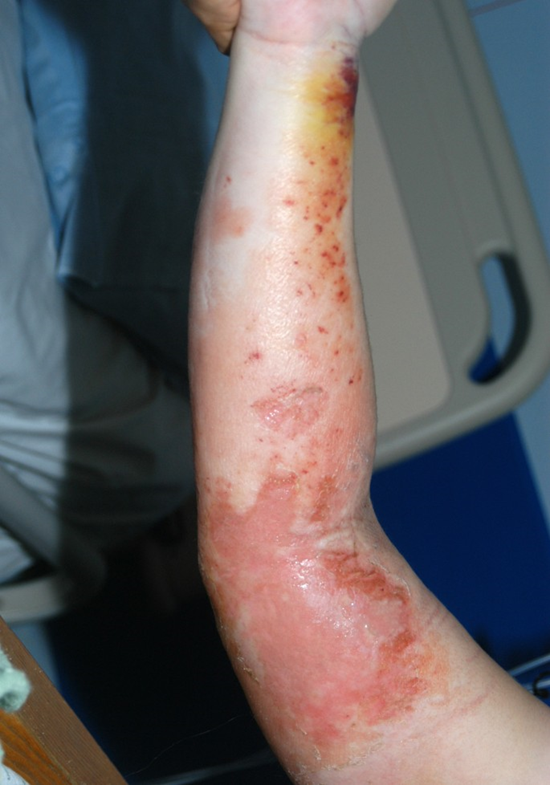
Immagine 03. Rash cutaneo al terzo giorno di ricovero per paziente affetto da sindrome da shock tossico.