Dettagli
- Definizione
- Epidemiologia
- Fattori che influenzano lo sviluppo della malattia
- Eziologia e patogenesi
- Diagnosi
- Classificazione della gravità
- Questionario modificato MRC per la Dispnea
- Valutazione CAT
- Terapia
- Trattamento di follow-up
BPCO
Definizione
La Broncopneumopatia cronica ostruttiva (BPCO) è una comune malattia, prevedibile e trattabile, caratterizzata da persistenti sintomi respiratori e limitazione al flusso aereo, che è dovuto ad anomalie delle vie aeree e/o alveolari solitamente causate da una significativa esposizione a particelle nocive o gas. La cronica limitazione al flusso aereo caratteristica della BPCO è causata in parte dalle alterazioni a carico delle piccole vie aeree (es., bronchiolite ostruttiva) e in parte dalla distribuzione parenchimale (enfisema). L’infiammazione cronica causa dei cambiamenti strutturali, il restringimento delle piccole vie aeree e la distribuzione del parenchima polmonare che porta alla perdita degli attacchi alveolari alle piccole vie aeree e alla riduzione della forza di retrazione elastica polmonare. A loro volta, queste alterazioni riducono la capacità delle vie aeree a mantenersi pervie durante la fase espiratoria. Il modo migliore per misurare l’entità della limitazione al flusso aereo è la spirometria che rappresenta il test di funzionalità polmonare più diffuso e riproducibile. I sintomi respiratori più comuni comprendono la dispnea, la tosse e/o la produzione di espettorato. Questi sintomi possono essere sottostimati dal paziente. La BPCO ha diverse complicazioni, tra cui l’esacerbazione acuta, l’insufficienza respiratoria e l’ipertensione polmonare. I tassi di mortalità a 4 anni vanno dal 28% per la BPCO da lieve a moderata al 62% per la BPCO da moderata a grave.
Epidemiologia
Colpisce comunemente gli adulti > 40 anni che fumano, con una prevalenza mondiale stimata del 4%-10%. Il decorso della malattia è solitamente progressivo con un declino a lungo termine della funzione polmonare ed è la terza causa di mortalità in tutto il mondo.
Fattori che influenzano lo sviluppo della malattia
Il fumo è il fattore di rischio più comune per la BPCO in tutto il mondo. Sebbene il fumo di sigaretta sia il fattore di rischio meglio studiato della BPCO, esso non è l’unico fattore ed esiste consistentemente evidenza da studi epidemiologici che anche i non fumatori possono sviluppare un’ostruzione cronica delle vie aeree. Ciò nonostante, i non fumatori con limitazione cronica al flusso aereo presentano minori sintomi rispetto a fumatori con BPCO, una malattia più lieve e un grado più lieve di infiammazione sistemica. Altri fattori di rischio includono:
- l’esposizione professionale (ad esempio, polveri organiche e inorganiche, agenti chimici e fumi);
- la carenza di alfa-1 anti-tripsina, un importante inibitore circolante delle proteasi sieriche;
- singoli geni, come il gene che codifica per la metallo-proteinasi 12 (MMP-12) e la glutatione S-transferasi, presentano una relazione con il declino della funzionalità polmonare;
- l’età, l’invecchiamento delle vie aeree e del parenchima imita alcuni cambiamenti strutturali associati alla BPCO;
- l’esposizione al fumo passivo può contribuire alla sintomatologia respiratoria e alla BPCO, aumentando il carico globale di particelle e gas inalati;
- l’inquinamento dell’aria interna (legno, escrementi animali, avanzi della coltivazione e carbone, solitamente bruciati in fuochi all’aria aperta, e stufe malfunzionanti, possono condurre a elevati livelli d’inquinamento degli ambienti interni);
- elevati livelli di inquinamento urbano sono dannosi nei soggetti cardiopatici o con patologia respiratoria. Un recente studio trasversale cinese ha mostrato un’associazione fra i livelli ambientali di sostanze particolate (PM 2.5/10) e la prevalenza di BPCO.
- la povertà è costantemente associata a malattie delle vie aeree ed un basso livello socioeconomico è associato ad un aumentato rischio di sviluppare BPCO. Non è chiaro, tuttavia, se questo rifletta l’esposizione ad inquinanti ambientali degli ambienti interni ed esterni, il vivere in ambienti affollati, la carenza di alimentazione, le infezioni o altri fattori correlati al basso livello socioeconomico;
- la presenza di bronchite cronica nei giovani adulti che fumano aumenta significativamente il rischio la probabilità di sviluppare BPCO;
- l’asma e l’iperreattività delle vie aeree;
- anamnesi positiva per gravi infezioni infantili è stata posta in relazione con una riduzione della funzionalità polmonare e con un aumento dei sintomi respiratori nell’adulto.
Eziologia e patogenesi
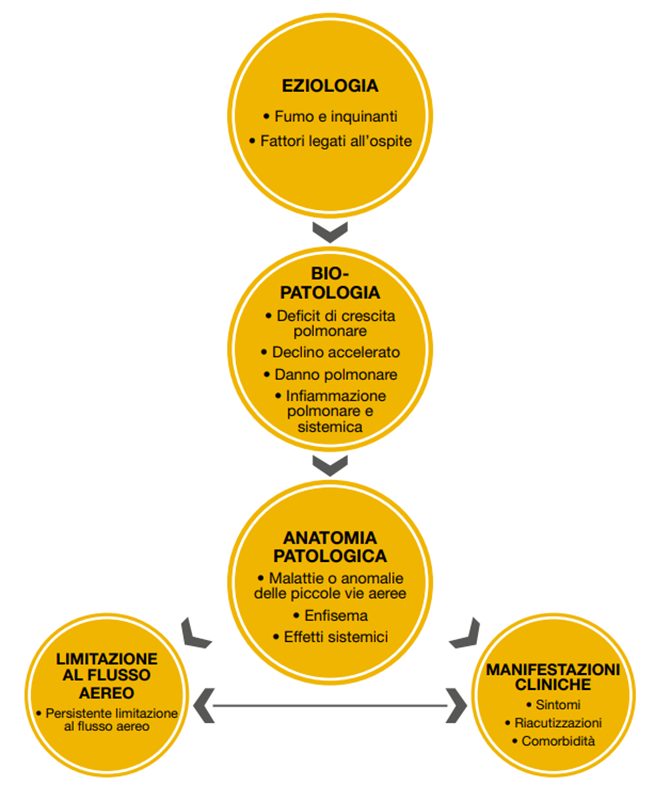
L’inalazione del fumo di sigaretta o di altre particelle nocive, come quello dei combustibili di biomassa, causa infiammazione polmonare che rappresenta una risposta normale che sembra essere modificata nei pazienti che sviluppano BPCO. L’infiammazione dell’albero bronchiale nel paziente con BPCO sembra essere una modifica della normale risposta infiammatoria del tratto respiratorio ad agenti irritanti cronici come il fumo di sigaretta. I meccanismi di questa infiammazione amplificata non sono ancora completamente compresi ma possono in parte essere geneticamente determinati. Questa risposta infiammatoria cronica può indurre distruzione del tessuto parenchimale (che determina enfisema), bronchiolite ostruttiva, rimodellamento delle piccole vie aeree, alterare i normali meccanismi di difesa e riparazione (conducendo alla fibrosi delle piccole vie aeree polmonari) e portando a intrappolamento aereo e a una progressiva limitazione al flusso aereo. Tale anomala infiammazione determina la limitazione del flusso d’aria, che è dovuta a:
- cambiamenti strutturali indotti dall’infiammazione, tra cui:
- rimodellamento e restringimento delle piccole vie aeree;
- distruzione dei parenti alveolari (enfisema);
- diminuzione del rinculo elastico nei pazienti con enfisema;
- conseguente riduzione della capacità delle vie aeree di rimanere aperte durante la scadenza a causa di una precedente compressione dinamica delle vie aeree;
- il restringimento e la scomparsa delle piccole vie aeree conduttrici sembrano avvenire prima dell’inizio della distruzione enfisematosa nei pazienti con BPCO;
Oltre quaranta anni fa furono descritte le caratteristiche cliniche, funzionali e radiologiche della BPCO differenziandola nei termini tipo A (pink puffer) e tipo B (blue bloater) per distinguere empiricamente i pazienti con un tipo enfisematoso da quelli con un tipo bronchitico di ostruzione cronica delle vie aeree. Questi termini hanno successivamente perso la loro connotazione nosografica e, senza che vi siano state dimostrazioni efficaci della loro mancata accuratezza nel definire forme diverse di ostruzione cronica delle vie aeree, sono stati definitivamente abbandonati. L’osservazione che spesso i reperti clinici ed anatomo-patologici dell’enfisema e della bronchite cronica si manifestino e coesistano in varia combinazione nello stesso paziente ha contribuito in modo sostanziale all’abbandono di questa terminologia.
Diagnosi
La diagnosi clinica di BPCO dovrebbe essere presa in considerazione in tutti i pazienti che presentano dispnea, tosse cronica o espettorazione e/o una storia di esposizione ai fattori di rischio per la malattia. La spirometria è necessaria per la diagnosi clinica in questo contesto clinico; la presenza di un rapporto VEMS/CVF < 0,70 post-broncodilatazione conferma la presenza di ostruzione bronchiale persistente e quindi della BPCO nei pazienti con sintomi appropriati e significative esposizioni a stimoli nocivi. Inoltre, prendere in considerazione l’uso della pulsossimetria per stimare l’ossigenazione in pazienti con sospetta insufficienza respiratoria o insufficienza cardiaca destra per saggiare la necessità di ossigenazione supplementare. La conta ematica completa può essere utile per rilevare anemia o policitemia. Infine, la radiografia toracica o tomografia computerizzata (TC) per valutare le comorbilità e diagnosi alternative.
La spirometria è risultata essere la più riproducibile, oggettiva, non invasiva e facilmente disponibile per la misurazione dell’ostruzione del flusso d’aria:
- la spirometria che dimostra un volume espiratorio forzato in 1 secondo (FEV1)/capacità vitale forzata (FVC) rapporto < 0,7 conferma la diagnosi;
- la misurazione singola del rapporto post-broncodilatatore FEV1/FVC 0,6-0,8 deve essere ripetuta in un’occasione separata;
- eseguire dopo la somministrazione di una dose adeguata broncodilatatore inalatorio a breve durata d’azione, come:
- 400 mcg beta-2 agonista a breve durata d’azione (SABA) (attendere 10-15 minuti prima del test);
- 160 mcg anticolinergico a breve durata d’azione (attendere 30-45 minuti prima del test);
- combinazione 400 mcg SABA/160 mcg anticolinergico a breve durata d’azione (attendere 30-45 minuti prima del test);
Classificazione della gravità
Secondo le linee guida GOLD:
- la diagnosi di BPCO applicata a pazienti con limitazione del flusso d’aria, definita come volume espiratorio forzato in 1 secondo (FEV1)/capacità vitale forzata (FVC) rapporto < 0,7;
- la gravità può essere basata sulla valutazione del FEV1 post-broncodilatatore.
Table 1. GOLD Classification for Severity of Airflow Limitation
| Severity | FEV1 |
| GOLD 1 (Mild) | => 80% predicted |
| GOLD 2 (Moderate) | 50%-79% predicted |
| GOLD 3 (Severe) | 30%-49% predicted |
| GOLD 4 (Very severe) | < 30% predicted |
| Abbreviations: FEV1, forced expiratory volume in 1 second; GOLD, Global Initiative for Chronic Obstructive Lung Disease. |
Le valutazioni della gravità dei sintomi include:
- il questionario modificato del British Medical Research Council (mMRC), che valuta l’affanno sulla base di una scala da 0 (affanno da sforzo) a 4 (troppo affanno per uscire di casa o affanno durante la vestizione o la svestizione);
- il COPD Assessment Test (CAT), un questionario a 8 voci del valore di 5 punti ciascuna (punteggio complessivo compreso tra 0 e 40) che può aiutare a determinare la qualità della vita del paziente.
Questionario modificato MRC per la Dispnea

Valutazione CAT

Le linee guida GOLD utilizzano “lo strumento di valutazione ABCD Modificato” per valutare la gravità GOLD basata sul carico dei sintomi e sul rischio di esacerbazione.
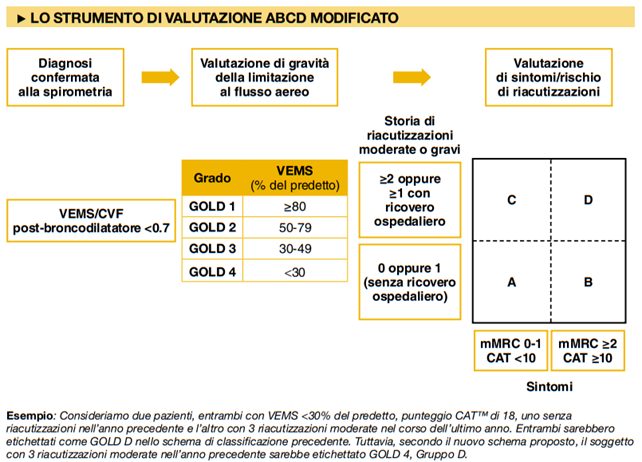
- Gruppo A:
- 0 esacerbazioni o 1 esacerbazione che non porta al ricovero in ospedale;
- mMRC punteggio 0-1;
- Punteggio CAT < 10.
- Gruppo B:
- 0 esacerbazioni o 1 esacerbazione che non porta al ricovero in ospedale;
- punteggio mMRC ≥ 2;
- Punteggio CAT ≥ 10;
- Gruppo C:
- ≥ 2 esacerbazioni o ≥ 1 esacerbazione che porta al ricovero in ospedale;
- mMRC punteggio 0-1;
- Punteggio CAT < 10.
- Gruppo D:
- ≥ 2 esacerbazioni o ≥ 1 esacerbazione che porta al ricovero in ospedale;
- punteggio mMRC ≥ 2;
- Punteggio CAT ≥ 10.
Terapia
Il trattamento della BPCO stabile dovrebbe essere basato soprattutto sulla valutazione individualizzata dei sintomi e del rischio futuro di riacutizzazione. Tutti i soggetti che fumano dovrebbero essere incoraggiati a smettere. I principali obiettivi del trattamento sono la riduzione dei sintomi e del rischio futuro di riacutizzazioni. Le strategie terapeutiche non sono limitate alla terapia farmacologica, e dovrebbero essere integrate da appropriati interventi non farmacologici.
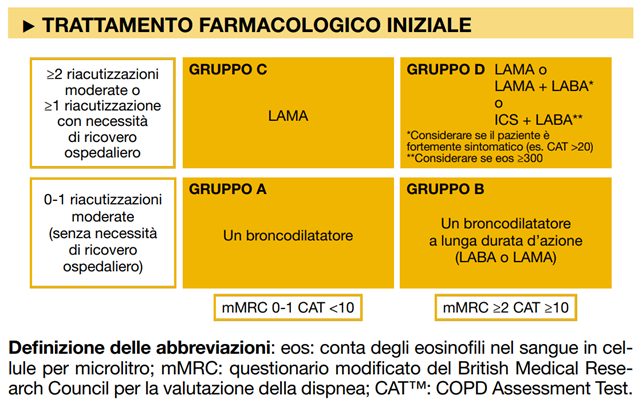
Le linee guida GOLD raccomandano un trattamento personalizzato per ogni gruppo:
Gruppo A:
- utile terapia farmacologica di prima linea con broncodilatatore a breve o lunga durata d’azione. La terapia dovrebbe essere continuata se vi è documentata efficacia sui sintomi.
Gruppo B:
- utile terapia farmacologica di prima linea con broncodilatatore a lunga durata d’azione (non ci sono prove a sostegno di una classe piuttosto che di un’altra e le decisioni dovrebbero essere prese in base alla percezione del sollievo dei sintomi da parte dei pazienti);
- se il respiro è persistente o gravemente affannoso in monoterapia, considerare l’aggiunta di un secondo broncodilatatore
Gruppo C:
- utile terapia farmacologica di prima linea con broncodilatatore a lunga durata d’azione (antagonista dei recettori muscarinici a lunga durata d’azione [LAMA] raccomandato rispetto all’agonista beta-2 a lunga durata d’azione [LABA])
Gruppo D:
- utile terapia farmacologica di prima linea:
- con LAMA nella maggior parte dei pazienti;
- oppure con combinazione LABA/LAMA in pazienti con sintomi gravi (Test di valutazione della BPCO (CAT) ≥ 20 punti), soprattutto se causata da un aumento della dispnea o da una limitazione dell’esercizio fisico;
- oppure con LABA/corticosteroidi inalati (ICS), che possono essere preferiti in pazienti con anamnesi suggestiva di sindrome da sovrapposizione asma-COPD o con conteggio di eosinofili nel sangue ≥ 300 cellule/mcL.
Trattamento di follow-up
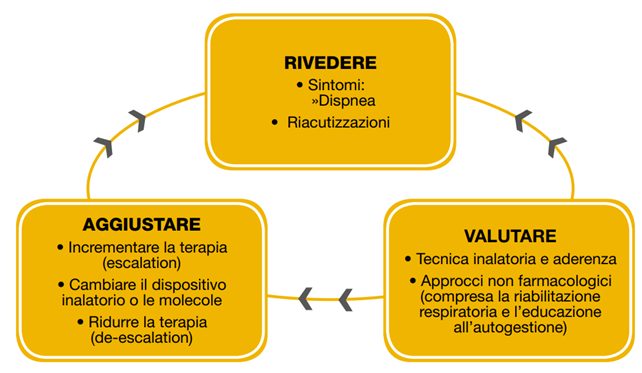
Le linee guida GOLD forniscono un algoritmo separato per il trattamento durante il follow-up, in cui la gestione è ancora basata sui sintomi e sulle riacutizzazioni, ma le raccomandazioni non dipendono dal gruppo GOLD del paziente alla diagnosi.

Se la dispnea persistente o la limitazione dell’esercizio fisico:
- in monoterapia LABA o LAMA, aggiungere un secondo broncodilatatore;
Nei pazienti con persistente dispnea o limitazione dell’attività fisica in trattamento con LABA/ICS, si può aggiungere un LAMA passando alla triplice terapia:
- in alternativa, si dovrebbe prendere in considerazione la possibilità di passare da LABA/ICS a LABA/LAMA se l’indicazione originale per la terapia con ICS è inappropriata (per es. è stato utilizzato un ICS per trattare i sintomi in assenza di una storia di riacutizzazione), se la risposta al trattamento con ICS è insufficiente, oppure se gli effetti collaterali degli ICS richiedono una sospensione del trattamento.
- Se non ci sono miglioramenti: considerare la possibilità di cambiare il dispositivo o le molecole dell’inalatore, oppure, indagare e trattare altre cause di dispnea.
Nei pazienti con persistenti riacutizzazioni:
- se assumono monoterapia con un broncodilatatore a lunga durata d’azione, si raccomanda l’escalation a LABA/LAMA o LABA/ICS. La combinazione LABA/ICS può essere preferita nei pazienti con una storia o reperti suggestivi di asma. La conta degli eosinofili nel sangue può identificare i pazienti con maggiore probabilità di risposta positiva agli ICS. Nei pazienti con una riacutizzazione all’anno, un livello di eosinofili nel sangue periferico ≥300/μL identifica i soggetti che hanno maggiori probabilità di rispondere al trattamento con LABA/ICS. Nei pazienti con ≥2 riacutizzazioni moderate all’anno o con almeno una riacutizzazione grave che ha richiesto l’ospedalizzazione nell’ultimo anno, il trattamento con LABA/ICS può essere preso in considerazione in caso di una conta di eosinofili nel sangue ≥100 cellule/μL, dal momento che gli effetti degli ICS sono più pronunciati nei pazienti con maggiore frequenza e/o gravità delle riacutizzazioni;
- Nei pazienti che sviluppano ulteriori riacutizzazioni durante trattamento con LABA/LAMA, noi suggeriamo due percorsi alternativi. Una conta di eosinofili nel sangue <100 cellule/μL può essere utilizzata per predire una bassa probabilità di risposta agli ICS:
- Escalation a LABA/LAMA/ICS. Una risposta positiva dopo aggiunta di ICS può essere osservata in caso di una conta di eosinofili nel sangue ≥100 cellule/μL, con risposte di maggiore entità più probabili in presenza di conte di eosinofili più elevate;
- Aggiungere roflumilast o azitromicina (vedi sotto) se il livello di eosinofili ematici <100 cellule/μL.
- Nei pazienti che sviluppano ulteriori riacutizzazioni durante trattamento con LABA/ICS, noi raccomandiamo l’escalation alla triplice terapia con l’aggiunta di un LAMA (97,147). In alternativa, il trattamento può essere modificato passando alla terapia con LABA/LAMA se la risposta al trattamento con ICS è stata insufficiente, o se gli effetti collaterali degli ICS richiedono una sospensione del trattamento.
- Se i pazienti trattati con LABA/LAMA/ICS hanno ancora riacutizzazioni, si possono prendere in considerazione le seguenti opzioni:
- Aggiungere roflumilast. Questa opzione può essere considerata nei pazienti con VEMS <50% del predetto e bronchite cronica, soprattutto se hanno avuto almeno una ospedalizzazione per riacutizzazione della BPCO nell’ultimo anno;
- Aggiungere un macrolide. Le maggiori evidenze riguardano l’uso dell’azitromicina, soprattutto nei fumatori. La decisione clinica dovrebbe considerare anche lo sviluppo di microrganismi resistenti.
- Interrompere la terapia con ICS. Questa opzione può essere considerata se vi sono effetti avversi (come la polmonite) o una riferita mancanza di efficacia. Ad ogni modo, una conta degli eosinofili nel sangue ≥300 cellule/μL identifica i pazienti con maggiori probabilità di andare incontro a riacutizzazione dopo interruzione della terapia con ICS; questi soggetti dovrebbero essere tenuti sotto stretta osservazione per la possibile comparsa di ricadute per riacutizzazione.
Altri trattamenti:
Inibitori della fosfodiesterasi-4 (PDE4):
- considerare l’aggiunta dell’inibitore della PDE4 per i pazienti (GOLD Evidenza B) con :
- esacerbazioni nonostante la terapia LABA/LAMA, LABA/ICS o LABA/LAMA/ICS;
- bronchite cronica;
- ostruzione del flusso d’aria da grave a molto grave;
- in pazienti con bronchite cronica, BPCO da grave a molto grave, e storia di esacerbazioni, gli inibitori della PDE4, come il roflumilast, raccomandato per:
- migliorare la funzione polmonare e ridurre le esacerbazioni da moderate a gravi (GOLD Evidenza A);
- miglioramento della funzione polmonare e diminuzione delle esacerbazioni nei pazienti con combinazioni LABA/ICS a dosaggio fisso (GOLD Evidenza B);
Ossigenoterapia:
- in pazienti con grave ipossiemia arteriosa cronica a riposo, ossigeno a lungo termine indicato in quanto aumenta la sopravvivenza (prova GOLD Evidenza A);
- indicata per ipossiemia arteriosa definita come: PaO2 < 55 mHG o SaO2 < 88%;
- indicata per PaO2 > 55 mmHg ma < 60 mmHg con insufficienza cardiaca destra oppure eritrocitosi.
Mucolitici:
- mucolitici antiossidanti consigliati solo in pazienti selezionati (prova GOLD Evidenza A)
- in pazienti selezionati, l’uso regolare di N-acetilcisteina (NAC) e carbocisteina riduce il rischio di esacerbazioni (GOLD Evidence B)
Antibiotici:
- i macrolidi, in particolare l’azitromicina, possono essere considerati preferibilmente per, ma non solo per gli ex fumatori con esacerbazioni nonostante una terapia appropriata (prova GOLD Evidence B)
- la terapia a lungo termine con azitromicina ed eritromicina riduce le esacerbazioni nell’arco di un anno (prova d’oro A)
- azitromicina associata ad un aumento del rischio di resistenza batterica (GOLD Evidenza A) e di danni all’udito (GOLD Evidenza B)
Vaccinazione:
- vaccino antinfluenzale raccomandato per tutti i pazienti con BPCO (prova GOLD Evidenza A)
- vaccino pneumococcico (PCV13 e PPSV23) raccomandato in (evidenza GOLD B)
- tutti i pazienti > 65 anni;
- pazienti più giovani con condizioni comorbidità significative, tra cui malattie croniche cardiache e polmonari.
Terapia di aumento dell’antitripsina IV alfa-1 (AAT):
- può essere preso in considerazione per i pazienti con grave deficit ereditario di AAT e con enfisema accertato (GOLD Evidenza B);
- può rallentare la progressione dell’enfisema (GOLD Evidenza B).
Metilxantine: gli effetti precisi dei derivati xantinici sono ancora controversi.
- La teofillina, la metilxantina più comunemente usata, è metabolizzata dal citocromo P450 con funzione di ossidasi mista. La clearance del farmaco diminuisce con l’età. Esiste l’evidenza di un effetto broncodilatatore modesto rispetto al placebo nella BPCO stabile. L’aggiunta di teofillina al salmeterolo produce un miglioramento maggiore del VEMS e della dispnea rispetto al salmeterolo da solo. Esistono evidenze limitate e contraddittorie per quanto riguarda l’effetto della teofillina a basse dosi sul tasso di riacutizzazioni. Effetti avversi: la tossicità è dose-dipendente; questo rappresenta un problema particolare con i derivati delle xantine poiché il loro indice terapeutico è basso e la maggior parte dei benefici compare solo quando vengono somministrate dosi quasi tossiche