Dettagli
Ipomagnesemia
L’ipomagnesemia è definita come una concentrazione plasmatica di magnesio < 1,5 mg/dl ed è considerata severa quando i livelli sierici di questo catione sono < 1 mg/dl. L’ipomagnesemia è di frequente riscontro nei pazienti ospedalizzati (7-12%) (5,6,7), ed è associata ad un aumento della mortalità.(8,9.10,11)
L’ipomagnesemia è spesso associata ad altre alterazioni elettrolitiche come l’ipocalcemia e l’ipokaliema, spesso refrattarie ad altri trattamenti. Bassi livelli plasmatici di potassio associati ad una condizione di ipomagnesemia rappresentano un importante fattore di rischio per lo sviluppo di severe aritmie, pertanto nei pazienti critici il magnesio viene spesso corretto fino a raggiungere i 2 mg/dl. (5,12)
CAUSE
L’ipomagnesemia può derivare da diverse cause (v. tabella). (3,8,13,14,15,16,17,18,19,20,21)

Diversi farmaci antibiotici e agenti chemioterapici (inclusi i farmaci biologici) possono inibire il riassorbimento del magnesio e aumentare le perdite renali. (22,23,24,25,26,27).
In particolare la somministrazione di Cisplatino è associata alla comparsa di ipomagnesemia in più del 90% dei casi dopo 3 cicli di terapia con una dose cumulativa > di 300 mg/m2. L’ipomagnesemia indotta dalla somministrazione di Cisplatino può derivare da un danno farmaco-indotto a livello del tubulo renale distale, sebbene l’esatto meccanismo non sia chiaro. (28)
Il secondo e il terzo giorno dopo la somministrazione di cisplatino è indicata un’integrazione con magnesio e.v. (29,30)
L’integrazione di magnesio attraverso la somministrazione endovenosa sembrerebbe essere correlata ad una riduzione del rischio di nefrotossicità da cisplatino. (31, 32)
Gli anticorpi monoclonali anti EGFR causerebbero invece ipomagnesemia inibendo il riassorbimento del magnesio mediato dai canali TRPM6 attraverso il tubulo contorto distale, aumentando quindi le perdite renali. (33,34)
Da una metaanalisi di 25 studi clinici randomizzati è emerso che il trattamento con anticorpi monoclonali anti-EGFR è associato ad un’incidenza di ipomagnesemia del 34%; inoltre l’utilizzo del Panitumumab sembrerebbe essere associato da un’incidenza maggiore rispetto al Cetuximab. (35)
Inoltre il riscontro di ipomagnesemia in corso di trattamento con Cetuximab in pazienti affetti da carcinoma del colon-retto metastatico potrebbe rappresentare un fattore predittivo di efficacia, (36,37,38) sebbene altri studi non abbiano confermato questi risultati. (39)
Il ruolo prognostico
dell’ipomagnesemia è stato recentemente segnalato anche in pazienti affetti da
carcinoma squamocellulare del distretto testa-collo trattati con Cetuximab. (40)
MANIFESTAZIONI CLINICHE
I sintomi di solito non si manifestano fino a quando la concentrazione di magnesio non scende sotto 1,2 mg/dl (0,49 mmol/l), sebbene la gravità dei sintomi possa non essere correlata con i livelli sierici di magnesio. (41)
Le manifestazioni più precoci dell’ipomagnesemia sono di solito disordini neuromuscolari e neuropsichiatrici (v. tabella).

Le alterazioni elettrocardiografiche possono includere l’allungamento degli intervalli PR e QT, appiattimento o inversione dell’onda T, perdita della concavità verso l’alto dell’ST .
DIAGNOSI
Il metodo più utilizzato per determinare lo stato corporeo del magnesio è la misurazione delle concentrazioni plasmatiche di questo ione, che spesso però non ne riflettono le reali riserve dell’organismo, a causa della sua distribuzione.
Normali livelli di magnesio possono essere rilevati anche in caso di carenza a livello intracellulare, poiché le riserve vengono reclutate per mantenere i livelli sierici entro i valori di normalità.
La valutazione dell’escrezione urinaria del magnesio nelle 24 ore può essere utile nel valutare le perdite renali di magnesio. In alcuni pazienti può essere utile il test di tolleranza al magnesio che misura l’escrezione urinaria del magnesio nelle 24 ore dopo un bolo intravenoso e che probabilmente è il più accurato per valutare lo stato del magnesio: la quantità di magnesio trattenuta risulta aumentata nei pazienti con ipomagnesemia e nei pazienti con un rischio aumentato di sviluppare una carenza di magnesio. (12,42,43)
Questo test è particolarmente utile nei casi in cui ci sia un forte sospetto clinico di ipomagnesemia in presenza di normali livelli di magnesio. (44)
In alternativa al magnesio sierico totale e al test di tolleranza al magnesio potrebbero essere valutati i livelli sierici di magnesio ionizzato, la forma attiva nel plasma; tuttavia è ancora oggetto di dibattito quali livelli di magnesio, totale o ionizzato, debbano essere monitorizzati nei pazienti critici. (45)
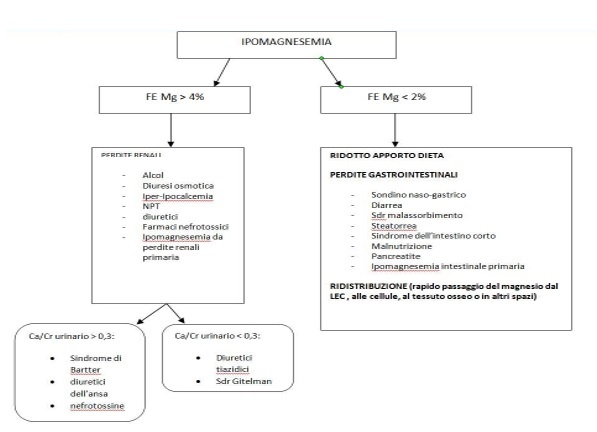
Per definire le cause dell’ipomagnesemia è importante misurare la frazione di escrezione del magnesio (FEMg) e il rapporto tra il calcio urinario e la creatinina (calcium-creatinina ratio) con un esame delle urine (v. tabella). (12,34,46)
FEMg: (magnesio urinario x creatinina plasmatica) / [0,7 (magnesio plasmatico x creatinina urinaria)] x 100.
Una FEMg < 2% suggerisce un ridotto apporto alimentare, perdite a livello gastrointestinale o una ridistribuzione all’interno delle cellule.
Una FEMg = 4% circa in un soggetto con funzionalità renale normale indica la presenza di perdite renali.
TRATTAMENTO
Considerata la mancata disponibilità di studi clinici analitici nei pazienti oncologici a supporto dei dati presenti in letteratura, le seguenti raccomandazioni relative al trattamento sono da considerarsi basate sull’opinione dei membri del gruppo di lavoro responsabile delle stesse. (LIVELLO DI EVIDENZA 4) e/o su disegni di studio non analitici come report di casi e serie di casi (livello di evidenza 3), pertanto con GRADO DELLA RACCOMANDAZIONE D.
Dipende dalla severità delle manifestazioni cliniche. Se possibile dovrebbero essere trattate le patologie sottostanti.
Nei pazienti a rischio di sviluppare una carenza di magnesio dovrebbero essere valutati indici laboratoristici e sintomi clinici e andrebbe preso in considerazione un eventuale trattamento a scopo profilattico anche in presenza di normali livelli sierici di magnesio. (44)
La correzione dell’ipomagnesemia può essere effettuata per via orale o endovenosa. È necessario tenere presente la supplementazione di calcio, potassio e fosfato nei pazienti con ipomagnesemia; è inoltre spesso presente un deficit di vitamina D che dovrebbe essere trattato.
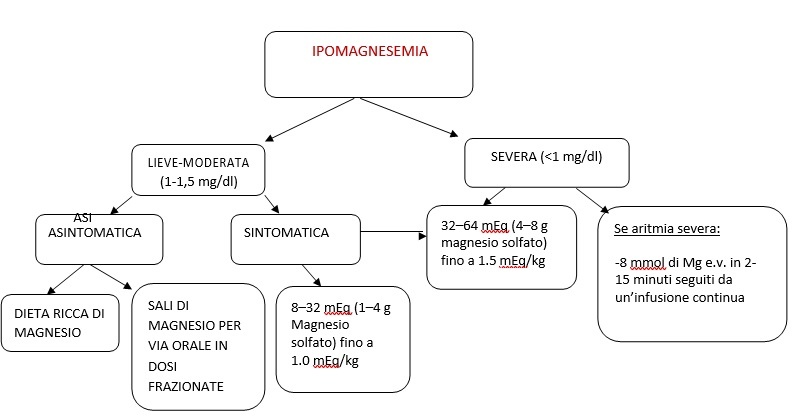
L’ipomagnesemia lieve – moderata può essere trattata con la dieta o con la somministrazione di magnesio per via orale. (47,48)
La somministrazione orale di sali di magnesio viene preferita nei pazienti asintomatici (40 -60 mEq/die o 8- 32 mEq/die in dosi frazionate); tuttavia la diarrea può manifestarsi come effetto collaterale dose-limitante. Può essere somministrata una dose iniziale di 12 mmol/die, incrementabile a 48 mmol/die. (49)
I pazienti sintomatici dovrebbero ricevere 1-4 g (8-32 mEq, fino ad un massimo di 1.0 mEq/kg) di solfato di magnesio e.v. infuso lentamente in 12-24 ore (1 g/ora). Questa dose può essere ripetuta se necessario per mantenere i livelli di magnesio a circa 1,2 mg/dl. (47)
Per correggere l’ipomagnesemia severa sono spesso necessari da 4 a 6 g (32-48 mEq fino ad un massimo di 1.5 mEq/kg) di solfato di magnesio. (9,50)
La velocità massima di infusione dovrebbe essere di 8 mEq/ora (1 g di solfato di magnesio l’ora fino a 100 mEq di magnesio (approssimativamente 12 g di magnesio solfato) in 12 ore nei pazienti asintomatici; fino a 32 mEq di magnesio (4 g di magnesio solfato) in 4–5 minuti nei pazienti con ipomagnesemia severa sintomatica. (19,21,42)
Dosi < 6 g MgSO4 possono essere somministrate in 8-12 h, mentre dosi più elevate andrebbero infuse in un periodo > 25 ore poiché la somministrazione rapida intravenosa di magnesio provoca un incremento delle concentrazioni sieriche di magnesio al di sopra dei livelli fisiologici aumentandone l’escrezione renale; pertanto, vista la lenta distribuzione del magnesio nei tessuti, la durata dell’infusione è fondamentale per ottenere un’ adeguata correzione dell’ipomagnesemia. (44)
Sempre a causa della lenta distribuzione nei tessuti, dopo l’infusione, la concentrazione plasmatica di magnesio può risultare falsamente elevata a causa della lenta distribuzione del magnesio nei tessuti. (51)
L’ipomagnesemia severa, sintomatica o associata alla presenza di aritmia, rappresenta un’indicazione alla correzione endovenosa in emergenza con 8 mmol di Mg e.v. in 2-15 minuti seguiti da un’infusione continua.(52)
É importante
valutare la funzionalità renale del paziente prima di un’eventuale
somministrazione di magnesio. I pazienti con insufficienza renale sono a
rischio di sviluppare ipermagnesemia e dovrebbero ricevere il 25%-50% della
dose iniziale raccomandata per pazienti con funzionalità renale normale. (47,
53)
È necessario un attento monitoraggio dei livelli di magnesio durante la somministrazione endovenosa (ogni 24-48 ore). L’infusione endovenosa rapida di magnesio può superare la soglia renale provocando un aumento dell’escrezione urinaria di magnesio e del rischio di sviluppare effetti collaterali. (54)
In caso di intossicazione andrebbe somministrato Calcio e.v. (100-200 mg in 5-10 minuti) così da antagonizzare gli effetti neuromuscolari e cardiovascolari del magnesio (53,55)
Recentemente alcuni autori hanno suggerito l’utilizzo di infusioni continue settimanali di magnesio come un’opzione sicura ed efficace nella gestione dell’ipomagnesemia correlata al trattamento con farmaci antitumorali, sebbene siano necessari altri studi di conferma. (56)
Pazienti con ipomagnesemia
provocata da diuretici tiazidici o dell’ansa così come i pazienti con perdite
renali o nefrotossicità da cisplatino potrebbero beneficiarsi del trattamento
con diuretici risparmiatori di potassio.
Bibliografia
- Weisinger JR & Bellorin-Font E. Magnesium and phosphorus. Lancet 1998; 352: 391–396.
- White RE & Hartzell HC. Magnesium ions in cardiac function. Regulator of ion channels and second messengers. Biochemical Pharmacology 1989; 38: 859–867.
- Reinhart RA. Magnesium metabolism. A review with special reference to the relationship between intracellular content and serum levels.Arch Intern Med. 1988 Nov;148(11):2415-20.
- Saris NE, Mervaala E, Karppanen H, Khawaja JA, Lewenstam A. Magnesium. An update on physiological, clinical and analytical aspects. Clin Chim Acta 2000; 294: 1-26.
- Whang R, Oei TO, Watanabe A. Frequency of hypomagnesemia in hospitalized patients receiving digitalis. Archives of Internal Medicine 1985;145:655.
- Whang R, Oei TO, Aikawa JK, Watanabe A, VannattaJ, Fryer A, Markanich M. Predictors of clinical hypomagnesemia. Hypokalemia, hypophosphatemia, hyponatremia, and hypocalcemia. Arch Intern Med 1984; 144: 1794-1796.
- Wong ET, Rude RK, Singer FR, Shaw STJr. A high prevalence of hypomagnesemia and hpermagnesemia in hospitalised patients. Am J Clin Pathol 1983; 79: 348-352.
- Salem M, Kasinski N, Andrei AM, Brussel T, Gold MR, Conn A, Chernow B. Hypomagnesemia is a frequent finding in the emergency department in patients with chest pain. Arch Intern Med. 1991 Nov;151(11):2185-90.
- Heaton FW. The kidney and magnesium homeostasis. Ann N Y Acad Sci. 1969; 162:775-85.
- Chernow B, Bamberger S, Stoiko M et al. Hypomagnesemia in patients in postoperative intensive care. Chest. 1989; 95:391-7. 164.
- Rubeiz GJ, Thill-Baharozian M, Hardie D et al. Association of hypomagnesemia and mortality in acutely ill medical patients. Crit Care Med. 1993; 21:203-9.
- al Ghamdi SM, Cameron EC & Sutton RA. Magnesium deficiency: pathophysiologic and clinical overview. American Journal of Kidney Disease 1994; 24: 737–752.
- Vamvakas S, Teschner M, Bahner U, Heidland A. Alcohol abuse: potential role in electrolyte disturbances and kidney diseases. Clin Nephrol 1998; 49: 205-213.
- de Valk VH. Magnesium in diabetes mellitus. Neth J Med 1999; 54: 139-146.
- Konrad M, Weber S. Recent advances in molecular genetics of hereditary magnesium-losing disorders. J Am Soc Nephrol. 2003;14:249-60.
- Konrad M, Schlingmann KP, Gudermann T. Insights into the molecular nature of magnesium homeostasis. Am J Physiol Renal Physiol. 2004;286:F599-605.
- Shah GM, Kirschenbaum MA. Renal magnesium wasting associated with therapeutic agents. Miner Electrolyte Metab. 1991;17:58-64.
- Frankel H, Haskell R, Lee SY et al. Hypomagnesemia in trauma patients. World J Surg. 1999; 23:966-9.
- Dickerson RN, Brown RO. Hypomagnesemia in hospitalized patients receiving nutritional support. Heart Lung. 1985; 14:561-9.
- Graber TW, Yee AS, Baker FJ. Magnesium: physiology, clinical disorders, and therapy. Ann Emerg Med. 1981; 10:49-57.
- Martin HE. Clinical magnesium deficiency. Ann N Y Acad Sci. 1969; 162:891- 900.
- Klastersky J. Side effects of ifosfamide. Oncology 2003;65(Suppl 2):7–10.
- Goldman RD, Koren G. Amphotericin B nephrotoxicity in children. J Pediatr Hematol Oncol 2004;26(7):421– 6.
- Swaminathan R. Disorders of metabolism 2. In: Textbook of Adverse Drug Reactions, Eds: Davies DM, RE Ferner, H de Glanville. 5th ed. Chapman & Hall Medical, London 1998; 442-540.
- Dorup I. Magnesium and potassium deficiency. Its diagnosis, occurrence and treatment in diuretic therapy and its consequences for growth, protein synthesis and growth factors. Acta Physiol Scand Suppl, 1994; 618: 1-55.
- Markmann M, Rothman R, Reichman B, Hakes T, Lewis JL,Jr, Rubin S, Jones W, Almadrones L, Hoskins W. Persistent hypomagnesemia following cisplatin chemotherapy in patients with ovarian cancer. J Cancer Res Clin Oncol 1991; 117: 89-90.
- Schrag D, Chung KY, Flombaum C, Saltz L. Cetuximab therapy and symptomatic hypomagnesemia. J. Natl. Cancer Inst. 2005;97(16):1221–1224)
- Taguchi T, Nazneen A, Abid MR, Razzaque MS. Cisplatin-associated nephrotoxicity and pathological events. Contrib Nephrol 2005;148:107–21.
- Goren MP. Cisplatin nephrotoxicity affects magnesium and calcium metabolism. Med Pediatr Oncol 2003;41(3):186–9.
- Lajer H, Kristensen M, Hansen HH, Nielsen S, Frokiaer J, Ostergaard LF, et al. Magnesium depletion enhances cisplatin-induced nephropathy.Cancer Chemother Pharmacol 2005;56(5):535–42
- Kidera Y, Kawakami H, Sakiyama T, Okamoto K, Tanaka K, Takeda M, Kaneda H, Nishina S, Tsurutani J, Fujiwara K, Nomura M, Yamazoe Y, Chiba Y, Nishida S, Tamura T, Nakagawa K. Risk factors for cisplatin- induced nephrotoxicity and potential of magnesium supplementation for renal protection. PLoS One. 2014 Jul 14;9(7):e101902. doi: 10.1371/journal.pone.0101902. eCollection 2014.
- Yamamoto Y, Watanabe K, Tsukiyama I, Matsushita H, Yabushita H, Matsuura K, Wakatsuki A. Nephroprotective effects of hydration with magnesium in patients with cervical cancer receiving cisplatin. Anticancer Res. 2015 Apr;35(4):2199-204.
- Muallem, S.,Moe,O.W.,.When EGF is offside, magnesium is wasted. 2007, J.Clin. Invest.117,2086–2089.
- Groenestege WM, Thebault S,vanderWijst J,vandenBerg D, Janssen R, Tejpar S, vandenHeuvel LP, vanCutsem E, Hoenderop JG, Knoers NV, Bindels RJ. Impaired basolateral sorting of pro-EGF causes isolated re- cessive renal hypomagnesemia. J.Clin.Invest. 2007, 117,2260–2267.
- Wang Q, Qi Y, Zhang D, Gong C, Yao A, Xiao Y, Yang J, Zhou F, Zhou Y. Electrolyte disorders assessment insolid tumor patients treated with anti-EGFR monoclonal antibodies : a pooled analysis of 25 randomized clinical trials.Tumour Biol. 2015, 36,3471–3482.
- Vincenzi B, Santini D, Galluzzo S, Russo A, Fulfaro F, Silletta M, Battistoni F, Rocci L, Zobel BB, Adamo V, Dicuonzo G, Tonini G. Early magnesium reduction in advanced colorectal cancer patients treated with cetuximab plus irinotecan as predictive factor of efficacy and outcome. Clin.CancerRes. 2008, 14, 4219–4224.
- Fujii H, Iihara H, Suzuki A, Kobayashi R, Matsuhashi N, Takahashi T, Yoshida K, Itoh Y. Hypomagnesemia is a reliable predictor for efficacy of anti-EGFR monoclonal antibody used in combination with first-line chemotherapy for metastatic colorectal cancer. Cancer Chemother Pharmacol. 2016 Jun;77(6):1209-15.
- Price T, Kim TW, Li J, Cascinu S, Ruff P, Suresh AS, Thomas A, Tjulandin S, Guan X, Peeters M. Final results and outcomes by prior bevacizumab exposure, skin toxicity, and hypomagnesaemia from ASPECCT: randomized phase 3 non-inferiority study of panitumumab versus cetuximab in chemorefractory wild-type KRAS exon 2 metastatic colorectal cancer. Eur J Cancer. 2016 Nov;68:51-59.
- Vickers MM, Karapetis CS, Tu D, O’Callaghan CJ, Price TJ, Tebbutt NC, Van Hazel G, Shapiro JD, Pavlakis N, Gibbs P, Blondal J, Lee U, Meharchand JM, Burkes RL, Rubin SH, Simes J, Zalcberg JR, Moore MJ, Zhu L, Jonker DJ. Association of hypomagnesemia with inferior survival in a phase III, randomized study of cetuximab plus best supportive care versus best suppor tive care alone: NCICCTG/AGITGCo.17.Ann.Oncol. 2013, 24,953–960.
- Bernad IP, Trufero JM, Urquizu LC, Pazo Cid RA2, de Miguel AC, Agustin MJ, Lanzuela M, Antón A. Activity of weekly paclitaxel-cetuximab chemotherapy in unselected patients with recurrent/metastatic head and neck squamous cell carcinoma: prognostic factors. Clin Transl Oncol. 2017 Jun;19(6):769-776. doi: 10.1007/s12094-016-1604-z. Epub 2017 Jan 24.
- Yu ASL. Disturbances of magnesium metabolism. In: The Kidney. Ed: Brenner BM. WB Saunders 6th Ed, Philadelphia, 1999; 1055-1070.
- Noronha JL, Matuschak GM. Magnesium in critical illness: metabolism, assessment, and treatment. Intensive Care Med. 2002; 28: 667-679.
- Herbert P, Mehta N, Wang J, Hindmarsh T, Jones G, Cardinal P. Functional magnesium deficiency in critically ill patients identified using a magnesium-loading test. Crit Care Med 1997; 25: 749–55.
- Hansen BA, Bruserud Ø. Hypomagnesemia in critically ill patients. J Intensive Care. 2018 Mar 27;6:21. doi: 10.1186/s40560-018-0291-y. eCollection 2018. Review.
- Yeh DD, Chokengarmwong N, Chang Y, Yu L, Arsenault C, Rudolf J, Lee-Lewandrowski E, Lewandrowski
- Elisaf M, Panteli K, Theodorou J, Siamopoulos KC. Fractional excretion of magnesium in normal subjects and in patients with hypomagnesemia. Magnes Res. 1997;10:315-20.
- Assadi F. Disorders of divalent ion metabolism. In: Assadi F, editor. Clinical decisions in pediatric nephrology: aproblem-solving approach to clinical cases. New York: Springer; 2008. p. 97-123
- Yamamoto M, Yamaguchi T. Causes and treatment of hypomagnesemia. Clin Calcium. 2007 Aug;17(8):1241-
- Augus ZS. Hypomagnesemia. J Am Soc Nephrol. 1999;10:1616-22.
- Nadler JL, Rude RK. Disorders of magnesium metabolism. Endocrinol Metab Clin North Am 1995; 24: 623- 641.
- Van Hook JW. Hypermagnesemia. Crit Care Clin. 1991; 7:215-23.
- Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, Kudenchuk PJ, Ornato JP, McNally B, Silvers SM, Passman RS, White RD, Hess EP, Tang W, Davis D, Sinz E, Morrison LJ Part 8: adult advanced cardiovascular life support: 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010 Nov 2;122(18 Suppl 3):S729-67.
- Velissaris D, Karamouzos V, Pierrakos C, Aretha D, Karanikolas M. Hypomagnesemia in Critically Ill Sepsis Patients. J Clin Med Res. 2015 Dec;7(12):911-8.
- Fawcett WJ, Haxby EJ, Male DA. Magnesium: physiology and pharmacology. Br J Anaesth. 1999; 83: 302- 320.
- Tong GM, Rude RK. Magnesium deficiency in critical illness. J Intensive Care Med. 2005 Jan-Feb;20(1):3-17. Review.
- Mateo-Carrasco H, Kostrzynski O, Ndefo O, Stapley S, Davies E, Agarwal R. Continuous magnesium infusions in the management of systemic anti-cancer therapy-related hypomagnesaemia. Int J Clin Pharm. 2017 Aug;39(4):657-661. doi: 10.1007/s11096-016-0416-0. Epub 2017 Apr 25.