Dettagli
- CAUSE
- MANIFESTAZIONI CLINICHE
- TRATTAMENTO
- IPONATREMIA
- CAUSE
- MANIFESTAZIONI CLINICHE
- DIAGNOSI
- TRATTAMENTO
- Bibliografia
Ipernatremia
L’ ipernatremia è definita come una concentrazione sierica di sodio superiore a 145 mEq/l. L’ipernatremia si può instaurare rapidamente entro 48 ore (ipernatremia acuta, molto rara) o, come più frequentemente accade, lentamente (ipernatremia cronica che insorge in un tempo > 48 ore)
CAUSE
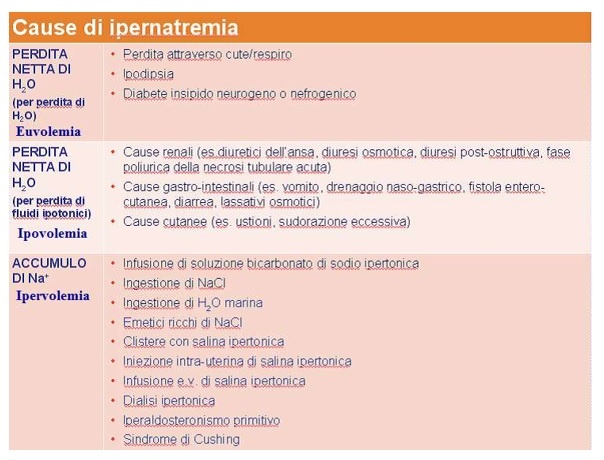
L’ipernatremia può derivare da diverse cause: per perdita netta di acqua (perdita di H20 o di fluidi ipotonici) o, raramente, per accumulo di sodio (spesso su base iatrogena) (vedi tabella sotto riportata).(6)
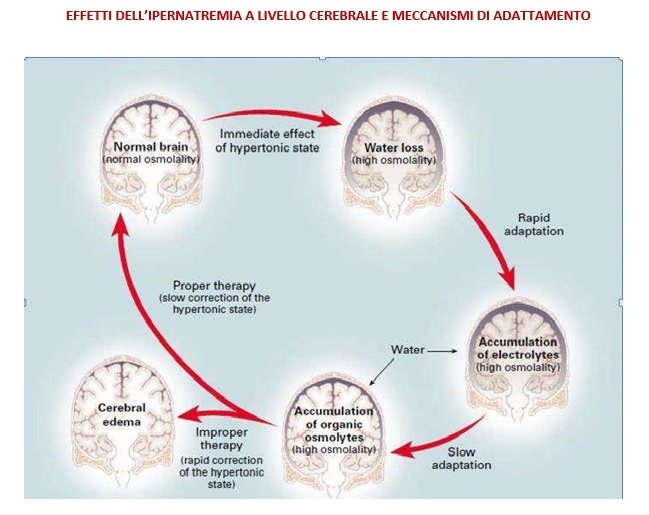
In conseguenza di un aumento dell’osmolalità, Volume Extra-Cellulare (VEC) il rapido movimento dell’acqua al di fuori del compartimento intracellulare provoca disidratazione cellulare nel giro pochi minuti. L’effetto è maggiore a livello neuronale rispetto alle altre cellule dell’organismo. Il volume cellulare viene parzialmente ripristinato entro poche ore grazie al re-ingresso, nei neuroni, degli elettroliti (adattamento rapido). Ciò determina il movimento dell’acqua dal liquido cerebrospinale, attraverso lo spazio interstiziale, verso il comparto intracellulare, ripristinando la dimensione della cellula. Il successivo up-take di soluti osmoticamente attivi comincia con il sodio, potassio e cloro, seguiti poi da osmoliti organici quali il mio- inositolo, la glutammina, il glutammato e la taurina.
La normalizzazione del volume cellulare si completa, così, nel giro di alcuni giorni (adattamento lento). Lo stato ipertonico comunque persiste. Una sua lenta correzione (in una settimana circa) ristabilisce una situazione di normale osmolarità cerebrale senza indurre edema cerebrale, dal momento che gli elettroliti e gli osmoliti organici vengono eliminati lentamente dalle cellule (terapia appropriata). Viceversa, una rapida correzione può causare edema cerebrale poiché l’ingresso di acqua all’interno delle cellule supera la capacità di eliminazione, da parte delle stesse, degli elettroliti e degli osmoliti organici (terapia inappropriata). (7,8)
MANIFESTAZIONI CLINICHE
Le manifestazioni cliniche dell’ipernatremia sono principalmente neurologiche e correlano sia con la gravità e con la rapidità di insorgenza: i sintomi risultano più evidenti in caso di rapido aumento della natremia.
I sintomi iniziali possono essere aspecifici:
- anoressia
- irrequietezza
- nausea
- debolezza muscolare
- letargia
- sete intensa (di solito si estingue al perdurare dell’ipernatremia e può essere assente nei pazienti ipodipsici)
- confusione
Questi sintomi possono progredire fino ad una più grave disfunzione del sistema nervoso centrale che può portare a:
- iperreflessia
- convulsioni
- coma (in particolare in caso di rapido carico di sodio)
La disidratazione cerebrale indotta dall’ipernatremia può causare complicazioni come emorragia cerebrale/subaracnoidea, con possibili danni permanenti o morte.
TRATTAMENTO
Considerata la mancata disponibilità di studi clinici analitici nei pazienti oncologici a supporto dei dati presenti in letteratura, le seguenti raccomandazioni relative al trattamento sono da considerarsi basate sull’opinione dei membri del gruppo di lavoro responsabile delle stesse (livello di evidenza 4) e/o su disegni di studio non analitici come report di casi e serie di casi (livello di evidenza 3), pertanto con GRADO DELLA RACCOMANDAZIONE D.
Il primo passo nella gestione dell’ipernatremia consiste nella conferma della diagnosi. Successivamente è importante:
1) rimuovere la causa, ove possibile.
2) correggere l’ipernatremia (deficit di acqua) in base alla volemia: Ripristino del volume intravascolare e dell’acqua libera
L’idratazione orale è efficace in pazienti collaboranti e in assenza di disfunzioni a carico dell’apparato gastrointestinale. In caso di severa ipernatremia o in pazienti con difficoltà nell’assunzione orale di liquidi a causa del vomito o delle alterazioni neurologiche, l’idratazione e.v. rappresenta una valida alternativa.
L’ipernatremia che insorge nell’arco di 24 ore dovrebbe essere corretta nelle successive 24 ore utilizzando soluzioni isotoniche o acqua senza aumentare il rischio di edema cerebrale. Una correzione di 1 mEq/l/h è considerata sicura in questi pazienti.(9)
L’ipernatremia, invece, definita cronica o ad esordio temporale non noto dovrebbe essere corretta in 48 ore, e l’osmolalità sierica dovrebbe essere ridotta ad una velocità non superiore a 0.5 mOsm/L/h per evitare l’insorgenza di edema cerebrale. Di conseguenza il valore del sodio sierico dovrebbe essere corretto alla medesima velocità, con una riduzione di non più di 8-10 mEq/l nell’arco delle 24 ore. (10,11)
Per tenere sotto controllo la velocità di correzione, occorre monitorizzare ad intervalli regolari la natremia, almeno una volta ogni 4 ore.
Il quantitativo di acqua (in liti) necessario per ripristinare il deficit, esistente in queste situazioni, può essere stimato con la formula di seguito riportata (il sodio sierico si intende in mEq/L):
Deficit di acqua libera= totale dell’acqua libera x [(sodio sierico)/140 -1]
Dove il totale dell’acqua libera, in litri, si calcola come il prodotto del peso (in Kg) per un coefficiente pari a
0.6 per gli uomini e 0.5 per le donne (assumendo come costante il sodio totale corporeo). Si tratta di una stima poichè nei pazienti con ipernatremia e deplezione del contenuto totale di sodio corporeo, il deficit di acqua libera risulta (benchè di poco) superiore rispetto a quello calcolato.
Nei pazienti con ipernatremia ed ipervolemia (eccesso nella quota di sodio totale corporeo), il deficit di acqua libera può essere ripristinato con soluzione 5% destrosio, a cui può essere integrato un diuretico dell’ansa. E’ utile monitorare il potassio sierico, specialmente nei diabetici, durante la correzione dell’ipernatremia: un’infusione troppo rapida della soluzione glucosata, può provocare glicosuria con aumento successivo dell’eliminazione di acqua libera inducendo nuovamente una situazione di ipertonicità.
Nei pazienti con ipernatremia ed euvolemia, il deficit di acqua libera può essere corretto somministrando fluidi ipotonici per os, attraverso sondino naso-gastrico o e.v. (es. soluzione 5% destrosio, NaCl 0.45%).
In pazienti con ipernatremia e ipovolemia, in particolare se diabetici in coma iperglicemico non chetogenico, per ripristinare il sodio e l’acqua libera, può essere somministrata una soluzione di NaCl 0.45%, in alternativa alla combinazione della soluzione fisiologica (0.9% NaCl) con quella 5% destrosio. Alternativamente, il volume extracellulare e l’acqua libera possono essere rimpiazzati separatamente mediante la formula sopracitata. In presenza di acidosi metabolica severa (pH <7.10), una soluzione di bicarbonato di sodio può essere aggiunta alla soluzione 5% destrosio o NaCl 0.45%. (9)
- Valgono le stesse norme di velocità di correzione sopramenzionate.
IPONATREMIA
L’iponatriemia è definita come una concentrazione sierica di sodio inferiore a 135 mmol/l.
L’iponatriemia è il disturbo elettrolitico più comune nei pazienti affetti da neoplasia sebbene la sua incidenza non sia chiara a causa di differenze riguardanti le varie neoplasie e i diversi cut-off considerati nelle diverse casistiche. (12,13,14,15) Tuttavia l’incidenza riportata nei pazienti affetti da tumore polmonare a piccole cellule è del 15%. (12)
L’iponatremia è associata ad un aumento della morbidità e mortalità rispetto alla normonatremia, con un incremento dell’ospedalizzazione, del numero di ricoveri per la stessa problematica e di conseguenza ad un aumento dei costi ospedalieri. (16,17)
CAUSE
CLASSIFICAZIONE IPONATREMIE
Le iponatremie possono essere suddivise in (18):
IPOTONICHE (ridotta osmolalità sierica)
NON IPOTONICHE
- IPERTONICHE (aumentata osmolalità sierica, es. in scompenso glicemico)
- ISOTONICHE (normale osmolalità sierica, es. per assorbimento di soluzioni irriganti sodio- prive utilizzate durante interventi uro/ginecologici)
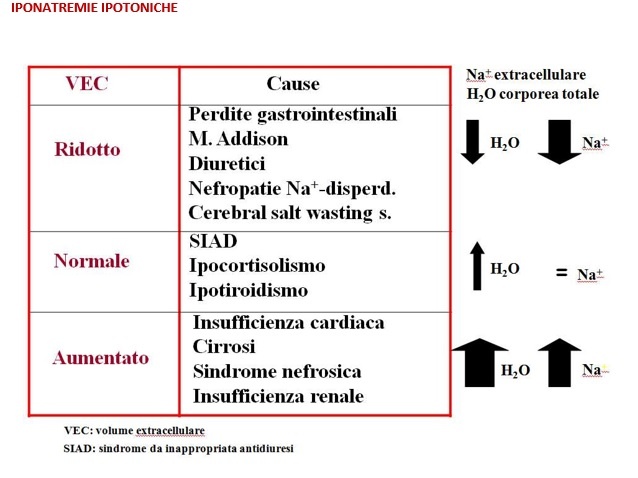
Le iponatremie ipotoniche sono espressione di un eccesso di acqua rispetto al contenuto di sodio che può essere normale, incrementato o diminuito.
L’eccesso di acqua può essere dovuto a:
- Eccessivo intake di acqua con normale capacità escretoria (es. polidipsia primaria)
- Alterata capacità escretoria renale di acqua
In base al volume extracellulare (VEC) si possono distinguere:
- Iponatremie con VEC ridotto
- Iponatremie con VEC aumentato
- Iponatremie con VEC normale
CAUSE DI SIAD
SIAD è un acronimo per sindrome da inappropriata anti-diuresi. (19) Tale termine è stato proposto per sostituire il termine sindrome da inappropriata secrezione di ADH (SIADH) dopo l’identificazione di casi di pazienti con le caratteristiche cliniche di SIADH, ma con ADH indosabile. In questi pazienti è stata identificata una mutazione attivante del recettore V2 dell’ADH. (20, 21, 22)
La SIAD è stata comunemente riportata nel tumore del polmone a piccole cellule. (23) Negli altri tumori, l’iponatremia e in alcuni casi la SIAD è causata più frequentemente da trattamenti farmacologici (analgesici, chemioterapici, antidepressivi, diuretici, antiemetici). Infine, l’iponatremia può essere dovuta agli effetti collaterali gastrointestinali, tipici di alcuni trattamenti chemioterapici, quali in particolare vomito e diarrea.
(24)

FARMACI ED IPONATREMIA
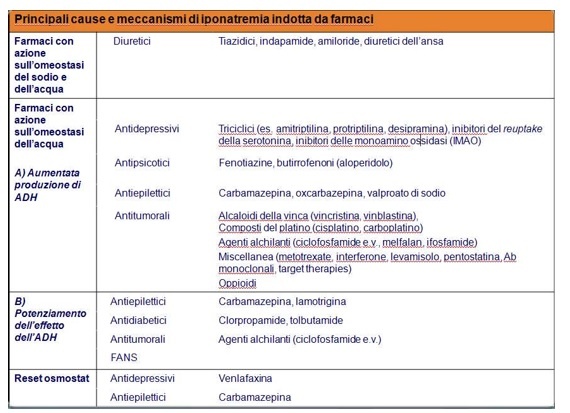
Diversi farmaci possono causare iponatremia secondaria o meno a SIAD (vedi tabella precedente), anche nei pazienti oncologici. (25,26)
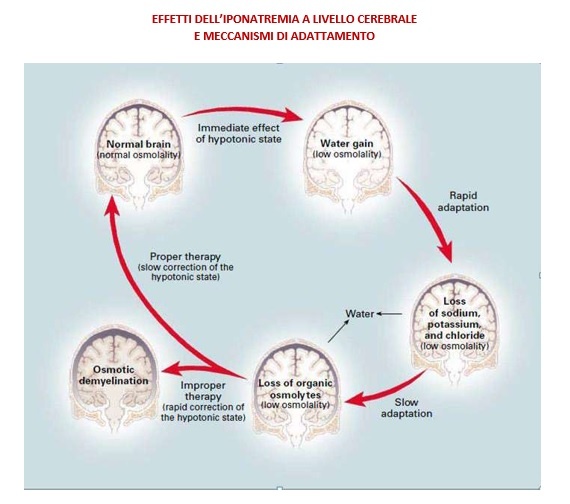
In conseguenza di una situazione di ipotonicità, l’accumulo di acqua da parte delle cellule cerebrali provoca rigonfiamento cellulare nel giro di pochi minuti. Il volume cellulare viene parzialmente ripristinato entro poche ore grazie all’eliminazione di elettroliti (adattamento rapido). La normalizzazione del volume cellulare si completa nel giro di alcuni giorni grazie alla perdita di osmoliti organici da parte delle cellule cerebrali (adattamento lento). Lo stato ipotonico comunque persiste. Una sua lenta correzione ristabilisce una situazione di normale osmolalità cerebrale, senza rischi di sofferenza cerebrale (terapia appropriata). Viceversa una rapida correzione può causare danni cerebrali irreversibili (es. sindrome da demielinizzazione osmotica) (terapia inappropriata).
MANIFESTAZIONI CLINICHE
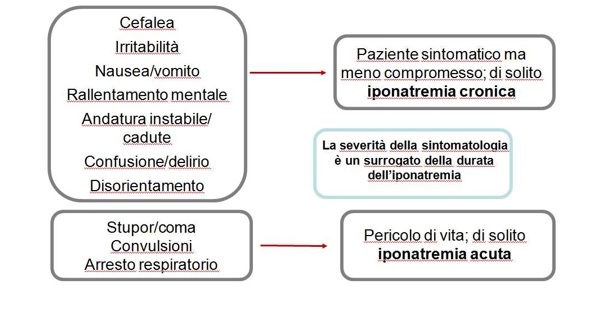
MANIFESTAZIONI NEUROLOGICHE DELL’IPONATREMIA SINTOMATICA (18,19)
COMPLICANZE DELL’IPONATREMIA
- Aumentato rischio di cadute (27)
- Aumentato rischio di fratture (28)
- Aumentato rischio di osteoporosi (29)
- Aumentato rischio di mortalità intra-ospedaliera (30,31)
DIAGNOSI
Per la diagnosi si può far riferimento all’algoritmo seguente (32):
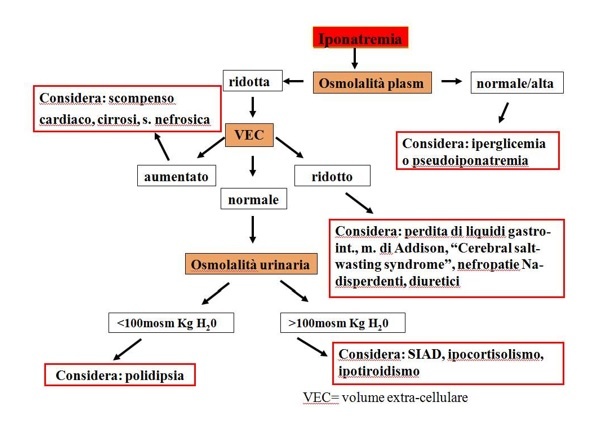
SIAD CRITERI DIAGNOSTICI MAGGIORI
La SIAD è la forma di iponatremia ipotonica euvolemica più frequente nel paziente affetto da neoplasia, interessando l’1–2% dei pazienti oncologici. (33) Inoltre, in presenza di iponatremia nel paziente neoplastico, la SIAD ne rappresenta la causa nel 30% dei casi. (33)
Per la diagnosi di SIAD sono stati identificati i seguenti criteri diagnostici maggiori (21,34,35):
- Iponatremia ipotonica (<275 mOsm/kg)
- “Inappropriata” osmolalità urinaria (>100 mOsm/kg H2O)
- Eliminazione urinaria di Na+ >30 mEq/L con normale assunzione di Na+ e H2O
- Clinicamente euvolemia (assenza di edemi o segni di deplezione volume)
- Normale funzione renale, surrenalica, tiroidea
- No uso di diuretici nella settimana precedente il riscontro.
TRATTAMENTO
Considerata la mancata disponibilità di studi clinici analitici nei pazienti oncologici a supporto dei dati presenti in letteratura, le seguenti raccomandazioni relative al trattamento sono da considerarsi basate sull’opinione dei membri del gruppo di lavoro responsabile delle stesse (livello di evidenza 4) e/o su disegni di studio non analitici come report di casi e serie di casi (livello di evidenza 3), pertanto con GRADO DELLA RACCOMANDAZIONE D.
La gestione terapeutica per l’iponatremia ipotonica in era pre-antagonisti recettoriali del recettore V2 dell’ADH (vaptani) prevedeva quanto segue (19, 32,34).
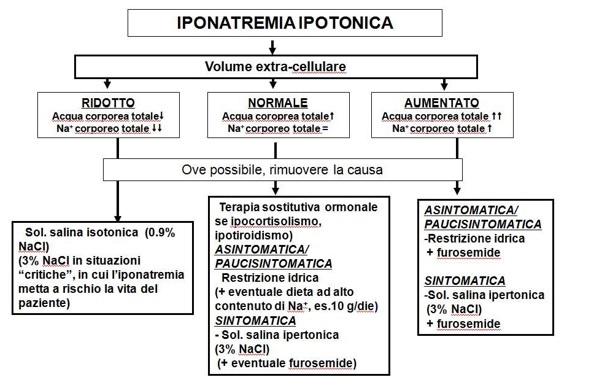
La valutazione del volume extra-cellulare di solito si basa sulla valutazione clinica del paziente.
Relativamente all’utilizzo dell’urea per il trattamento dell’iponatremia, specialmente in caso di SIAD, esso è stato proposto negli anni ’80. (33, 34) L’urea è capace di aumentare l’eliminazione dell’acqua libera da parte del rene. Il dosaggio dell’urea, nei pazienti con SIAD, va dai 15 ai 30 g/die per via orale dopo un pasto in una o due dosi. (36) Benchè in alcuni studi sia riportata l’efficacia dell’urea nel normalizzare la sodiemia, l’ipercorrezione con l’insorgenza di ipernatremia è stata descritta non di rado, negli stessi studi. L’entità dell’incremento del sodio sierico, infatti, non è facilmente prevedibile con l’assunzione di urea in quanto determinata anche dallo stato di idratazione del paziente e dall’osmolalità urinaria. Pertanto, l’urea, dovrebbe essere considerata in principio in assenza di efficacia della restrizione idrica o quando questa non sia fattibile. (37)
In uno studio prospettico condotto su pazienti con tumore polmonare a piccole cellule con SIAD, il tolvaptan è stato in grado di correggere e successivamente stabilizzare i livelli di sodio sierico, consentendo agli stessi di ricevere la chemioterapia senza alcun ritardo. Inoltre, il tolvaptan riduce il rischio di iponatremia conseguente alla stessa chemioterapia. (38,39)
Dopo l’introduzione del tolvaptan (primo e finora unico vaptano validato da EMA ed AIFA in EUROPA per il trattamento dell’iponatremia secondaria a SIAD), in aggiunta alle terapie “tradizionali” si può considerare, quindi, il trattamento con questo farmaco nelle condizioni di sintomatologia lieve o moderata (figura seguente). (30,32,35)
La durata del trattamento per l’iponatremia dipende in gran parte dalla causa. Nell’iponatremia indotta da farmaci, l’alterazione elettrolitica viene di solito ripristinata entro pochi giorni dalla cessazione del farmaco coinvolto. Al contrario, nei tumori che secernono ADH, l’iponatremia richiede, di solito, una terapia più lunga e imprevedibile, che dipende anche dalla risposta ai trattamenti anti-tumorali. (40) L’iponatremia deve essere pertanto attentamente considerata e corretta nei pazienti oncologici, preferibilmente evitando severe restrizioni di liquidi o farmaci che possono aumentare la nausea (urea), tenendo conto che la normalizzazione dei livelli di sodio è stata correlata positivamente con la prognosi e con la riduzione della durata della degenza ospedaliera. (39,40,41,42,43,44,45,46,47,48)
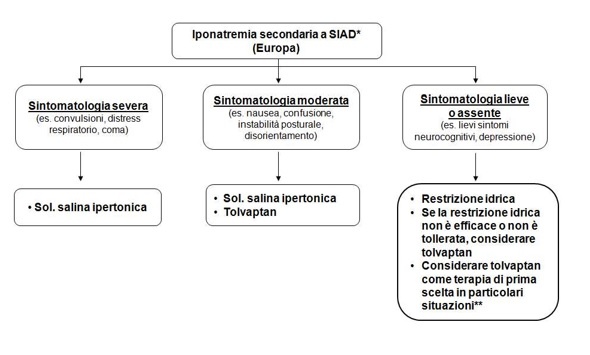
- *Altre opzioni, inclusi diuretici dell’ansa, o sospensione di farmaci he possono indurre iponatremia possono essere considerate caso per caso. Un trattamento specifico della condizione che ha causato iponatremia dovrebbe essere avviato quando possibile.
** Ad es. in pazienti iponatremici che devono essere sottoposti a procedure chirurgiche o a chemioterapia.
PREPARAZIONE DELLA SOLUZIONE SALINA AL 3% :
Se si tolgono a 500 ml S.F. (0.9%) 100 ml e si aggiungono 10 fiale da 10 ml di salina ipertonica 11.7%, si hanno 500 ml di soluzione al 3% NaCl.
FORMULA PER IL CALCOLO DELLA VELOCITA’ DI INFUSIONE DELLA SOL. SALINA (18):

CALCOLO VELOCITA’ INFUSIONE SOL. SALINA 3% (METODO SEMPLIFICATO):
La velocità di infusione può essere calcolata tenendo conto che 1.2 ml per ogni kg di peso corporeo aumenta la sodiemia di circa 1 mmol/L.
Es. in un pz di 70 kg si vuole aumentare la sodiemia di 0.5 mmol/L/h: 1.2 x 70 = 84 ml/h (aumento 1 mmol/L/h). Se si vuole aumento di 0.5 mmol/L/h: 84/2 = 42 ml/h.
Una regola generale da tenere presente è che l’iponatremia deve essere corretta lentamente, per evitare il rischio di danno cerebrale dovuto ad una correzione troppo aggressiva. Un’iniziale velocità di correzione, maggiore rispetto alla norma va riservata alle forme acute con sintomatologia severa in cui vi sia un concreto rischio di morte per il paziente. Comunque anche in queste forme un aumento iniziale della natremia di 4-6 mmol/L è sufficiente a contrastare efficacemente le più gravi manifestazioni cliniche ed a ridurre marcatamente la pressione intracranica.
In ogni situazione di iponatremia è comunque opportuno limitare la velocità di correzione della natremia ad 8 mmol/L in 24 ore; tale limite dovrebbe essere ridotto a 4-6 mmol /L in 24 ore in pazienti ad elevato rischio di sindrome da demielinizzazione osmotica (es. in pazienti con storia di alcoolismo, malnutrizione, malattia epatica in stato avanzato, con concomitante ipopotassiemia, o con concentrazioni sieriche di Na+ < 105 mmol/L). Tenere presente che i pazienti con iponatremia cronica (insorta da più di 48 ore) sono in principio esposti ad un maggior rischio di sindrome da demielinizzazione osmotica rispetto a quelli con iponatremia acuta. (21)
Per tenere sotto controllo la velocità di correzione, occorre monitorizzare ad intervalli regolari la natremia, almeno una volta ogni 4 ore.
RESTRIZIONE IDRICA:
Una norma utilizzabile prevede che l’introito giornaliero massimo di liquidi sia pari alla diuresi delle 24 ore precedenti – 500 ml.
TOLVAPTAN:
Somministrazione orale (compresse da 15 e 30 mg), una volta al giorno (picco concentrazione plasmatica dopo 2 h, emivita circa 8 ore), preferibilmente al mattino indipendentemente dai pasti.
I pazienti in terapia con tolvaptan possono e devono bere in risposta alla sete. La dose può essere aumentata gradualmente (ad intervalli >24 h fino ad un massimo di 60 mg/die) per raggiungere la correzione della natremia desiderata.
Nella fase di titolazione della dose, a causa della necessità di uno stretto monitoraggio della natremia e della volemia, il tolvaptan deve essere somministrato in regime di ricovero ospedaliero.
TOLVAPTAN E EPATOTOSSICITA’:
si riporta a seguire riassunto della nota informativa importante concordata con le autorità regolatorie europee e l’agenzia italiana del farmaco (AIFA) 20 maggio 2013:
Ulteriori informazioni che interessano la sicurezza
- Nel tempo trial, condotto per un’indicazione diversa [malattia policistica renale autosomica dominante (ADPKD)] da quella per la quale il farmaco è attualmente approvato in Europa, “3 pazienti trattati con tolvaptan hanno sviluppato aumenti significativi (>3 volte il limite superiore della norma [ULN]) dell’alanina aminotransferasi (ALT) sierica, con concomitanti aumenti clinicamente significativi (>2 volte l’ULN) della bilirubina totale sierica. Dopo l’interruzione del trattamento i 3 pazienti sono migliorati.” (49)
- In tale studio la dose giornaliera massima somministrata di tolvaptan (90 mg al mattino e 30 mg il pomeriggio) era maggiore della dose giornaliera massima di 60 mg approvata in Italia per il trattamento dell’iponatremia.
- Un gruppo esterno di esperti epatologi ha valutato questi 3 casi come probabilmente o molto probabilmente provocati da tolvaptan.
- In altri studi clinici su tolvaptan, compresi quelli a supporto dell’indicazione approvata, non è stata osservata un’incidenza maggiore di danno epatico rispetto al placebo. (50)
- Tuttavia, questi dati non sono sufficienti per escludere la possibilità che i pazienti che assumono tolvaptan per l’uso approvato come trattamento dell’iponatremia secondaria a SIAD presentino potenzialmente un maggior rischio di sviluppare danno epatico.
- I test di funzionalità epatica devono essere eseguiti tempestivamente nei pazienti in terapia con tolvaptan che riferiscono sintomi che possono indicare danno epatico, compresi stanchezza, anoressia, fastidio all’addome superiore destro, urina di colore scuro o ittero.
- In caso di sospetto danno epatico, l’assunzione di tolvaptan deve essere interrotta immediatamente, deve essere avviato un opportuno trattamento e devono essere effettuate indagini per determinare la probabile causa.
- La terapia con tolvaptan non va ripresa a meno che la causa del danno epatico osservato sia definita con certezza come non correlata al trattamento con tolvaptan. (51)
Bibliografia
- Masilamani S, Kim GH, Mitchell C et al. Aldosterone-mediated regulation of ENaC alpha, beta, and gamma subunit proteins in rat kidney. Journal of Clinical Investigation 1999; 104: R19–R23.
- Schneider EG, Radke KJ, Ulderich DA & Taylor Jr. RE. Effect of osmolality on aldosterone secretion. Endocrinology 1985; 116: 1621–1626.
- Hall JE, Granger JP, Smith Jr. MJ & Premen AJ. Role of renal hemodynamics and arterial pressure in aldosterone ‘escape’. Hypertension 1984; 6: 1183–1192)
- Robertson GL. Posterior pituitary. In Felig P, et al. (eds) Endocrinology and Metabolism. New York: McGraw-Hill, 1995, pp 385–432.
- Knepper MA. Molecular physiology of urinary concentrating mechanism: regulation of aquaporin water channels by vasopressin. American Journal of Physiology 1997; 272: F3–F12.)
- Adroguè HJ and Madias EN, Hypernatremia. N Eng J Med 342: 1493–1499, 2000.
- McDowell ME, Wolf AV, Steer A. Osmotic volumes of distribution; idiogenic changes in osmotic pressure associated with administration of hypertonic solutions. Am J Physiol (1955)180: 545–558.
- Melton JE, Patlak CS, Pettigrew KD et al. Volume regulatory loss of Na, Cl, and K from rat brain during acute hyponatremia. Am J Physiol (1987)252: F661–F669
- Pfennig CL, et al. Sodium disorders in the emergency department: a review of hyponatremia and hypernatremia. Emerg Med Pract. 2012;14(10):1–26.
- Reynolds RM, et al. Disorders of sodium balance. BMJ. 2006;332(7543):702–705.
- Kahn A, et al. Controlled fall in natremia and risk of seizures in hypertonic dehydration. Intensive Care Med. 1979;5(1):27–31.
- Berghmans T, Paesmans M, Body JJ. A prospective study on hyponatraemia in medical cancer patients: epidemiology, aetiology and differential diagnosis. Support Care Cancer. 2000 May; 8(3): 192-7.
- Castillo JJ, Vincent M, Justice E. Diagnosis and management of hyponatremia in cancer patients. Oncologist. 2012; 17(6): 756-65.
- Doshi SM, Shah P, Lei X, Lahoti A, Salahudeen AK. Hyponatremia is hospitalized cancer patients and its impact on clinical outcomes. Am J Kidney Dis. 2012;59(2):222-228.
- Ghali JK. Mechanisms, risks, and new treatment options for hyponatremia. Cardiology. 2008; 111(3): 147-57.
- Corona G, Giuliani C, Parenti G, Norello D, Verbalis JG, Forti G et al Moderate hyponatremia is associated with increased risk of mortality: evidence from a meta-analysis. PLoS One (2013) 8(12):e80451
- Corona G, Giuliani C, Parenti G, Colombo GL, Sforza A, Maggi M et al The economic burden of hyponatremia: systematic review and meta-analysis. Am J Med. (2016) 129(8):823e4–835e4Sorensen JB, Anderson MK, Hansen HH. Syndrome of inappropriate secretion of antidiuretic hormone (SIADH) in malignant disease. J Intern Med 1995;238:97-110.
- Adroguè HJ, Madias NE (2000) Hyponatremia. N Engl J Med 342(21):1581–1589
- Ellison DH, et al. Clinical practice. The syndrome of inappropriate antidiuresis. N Engl J Med., 2007, 356:2064-72.
- Rondon-Berrios H, Berl T. Vasopressin receptor antagonists: characteristics and clinical role. Best Pract Res Clin Endocrinol Metab (2016) 30(2):289–303.
- Verbalis JG, Goldsmith SR, Greenberg A, Korzelius C, Schrier RW, Sterns RH et al. Diagnosis, evaluation, and treatment of hyponatremia: expert panel recommendations. Am J Med (2013) 126(10 Suppl 1):S1–S42.
- Spasovski G, Vanholder R, Allolio B, Annane D, Ball S, Bichet D et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Nephrol Dial Transplant (2014) 29(Suppl 2):i1–i39.
- Grohé C, Berardi R, Burst V. Hyponatraemia–SIADH in lung cancer diagnostic and treatment algorithms. Crit Rev Oncol Hematol. 2015 Oct;96(1):1-8.
- Feldman BJ1, Rosenthal SM, Vargas GA, Fenwick RG, Huang EA, Matsuda-Abedini M, Lustig RH, Mathias RS, Portale AA, Miller WL, Gitelman SE. Nephrogenic syndrome of inappropriate antidiuresis. N Engl J Med. 2005 May 5;352(18):1884-90.
- Modificata da Liamis G, et al. A review of drug-induced hyponatremia. Am J Kidney Dis. 2008, 52: 144-153.
- Berardi R, Santoni M, Rinaldi S, Nunzi E, Smerilli A, Caramanti M, Morgese F, Torniai M, Savini A, Fiordoliva I, Onofri A, Pistelli M, Taccaliti A, Cascinu S. Risk of Hyponatraemia in Cancer Patients Treated with Targeted Therapies: A Systematic Review and Meta-Analysis of Clinical Trials. PLoS One. 2016;11(5):e0152079.
- Renneboog et al. Mild chronic hyponatremia is associated with falls, unsteadiness, and attention deficits. Am J Med. 2006, 119: 71.e1-71.e8.
- Kinsella et al. Hyponatremia independent of osteoporosis is associated with fracture occurrence. Clin J Am Soc Nephrol. 2010, 5: 275-280.
- Verbalis et al. Hyponatremia-induced osteoporosis. J Bone Miner Res. 2010, 25:554-563.
- Parenti et al. A case of hyponatremia caused by central hypocortisolism. Nat Clin Pract Endocrinol Metab. 2007, 3:369-375.
- Corona et al. Moderate hyponatremia is associated with increased risk of mortality: evidence from a meta- analysis. PloS One, 2013, 8(12):e80451.
- Glover DJ, Glick JH Metabolic oncologic emergencies. CA Cancer J Clin (1987) 37(5):302–320 21. Silverman P, Distelhorst CW Metabolic emergencies in clinical oncology. Semin Oncol (1989) 16(6):504–515 22. Berghmans T, Paesmans M, Body JJ A prospective study on hyponatraemia in medical cancer patients: epidemiology, aetiology and diferential diagnosis. Support Care Cancer (2000) 8(3):192–197.
- Bartter FC e Schwartz WB. The syndrome of inappropriate secretion of antidiuretic hormone. Am J Med 1967, 42: 790–806.
- Schrier RW. Body water homeostasis: clinical disorders of urinary dilution and concentration. J Am Soc Nephrol. 2006, 17:1820–1832.
- Peri A, Grohé C, Berardi R, Runkle I. SIADH: differential diagnosis and clinical management. Endocrine. 2017;55(1):311-319.
- Sterns RH, Silver SM, Hix JK Urea for hyponatremia? Kidney Int (2015) 87(2):268–270 26. Decaux G, Unger J, Brimioulle S, Mockel J Hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Rapid correction with urea, sodium chloride, and water restriction therapy. JAMA (1982) 247(4):471–474.
- Decaux G, Unger J, Brimioulle S, Mockel J Hyponatremia in the syndrome of inappropriate secretion of antidiuretic hormone. Rapid correction with urea, sodium chloride, and water restriction therapy. JAMA (1982)247(4):471–474.
- Petereit C, Zaba O, Teber I, Luders H, Grohe C. A rapid and efficient way to manage hyponatremia in patients with SIADH and small cell lung cancer: treatment with tolvaptan. BMC Pulm Med (2013) 13:55 30.
- Peri A. Clinical review: the use of vaptans in clinical endocrinology. J Clin Endocrinol Metab. 2013, 98:1321- 32.
- Cuesta M, Garrahy A, Thompson CJ. SIAD: practical recommendations for diagnosis and management. J Endocrinol Invest (2016) 39(9):991–100.
- Verbalis JG. Managing hyponatremia in patients with syndrome of inappropriate antidiuretic hormone secretion. Endocrinol Nutr (2010) 57(Suppl 2):30–40 31.
- Berardi R, Caramanti M, Castagnani M, Guglielmi S, Marcucci F, Savini A et al. Hyponatremia is a predictor of hospital length and cost of stay and outcome in cancer patients. Support Care Cancer (2015) 23(10):3095– 3101.
- Sbardella E, Isidori AM, Arnaldi G, Arosio M, Barone C, Benso A, Berardi R, Capasso G, Caprio M, Ceccato F, Corona G, Della Casa S, De Nicola L, Faustini-Fustini M, Fiaccadori E, Gesualdo L, Gori S, Lania A, Mantovani G, Menè P, Parenti G, Pinto C, Pivonello R, Razzore P, Regolisti G, Scaroni C,Trepiccione F, Lenzi A, Peri A; the: Fluid and Electrolyte Disorders Club of the Italian Society of Endocrinology; Italian Society of Nephrology; and Italian Association of Medical Oncology. Approach to hyponatremia according to the clinical setting: Consensus statement from the Italian Society of Endocrinology (SIE), Italian Society of Nephrology (SIN), and Italian Association of Medical Oncology (AIOM). J Endocrinol Invest. 2018 Jan;41(1):3-19.
- Tzoulis P, Carr H, Bagkeris E, Bouloux PM. Improving care and outcomes of inpatients with syndrome of inappropriate antidiuresis (SIAD): a prospective intervention study of intensive endocrine input vs. routine care. Endocrine. 2017 Feb;55(2):539-546.
- Berardi R, Santoni M, Newsom-Davis T, Caramanti M, Rinaldi S, Tiberi M, Morgese F, Torniai M, Pistelli M, Onofri A, Bower M, Cascinu S. Hyponatremia normalization as an independent prognostic factor in patients with advanced non-small cell lung cancer treated with first-line therapy. Oncotarget. 2017;8(14):23871-23879.
- Fiordoliva I, Meletani T, Baleani MG, Rinaldi S, Savini A, Di Pietro Paolo M, Berardi R. Managing hyponatremia in lung cancer: latest evidence and clinical implications. Ther Adv Med Oncol. 2017 Nov;9(11):711-719.
- Berardi R, Antonuzzo A, Blasi L, Buosi R, Lorusso V, Migliorino MR, Montesarchio V, Zilembo N, Sabbatini R, Peri A. Practical issues for the management of hyponatremia in oncology. Endocrine. 2018 Feb 7.
- Berardi R, Rinaldi S, Caramanti M, Grohè C, Santoni M, Morgese F, Torniai M, Savini A, Fiordoliva I, Cascinu S. Hyponatremia in cancer patients: Time for a new approach. Crit Rev Oncol Hematol. 2016 Jun;102:15-25.
- Torres VE, Chapman AB, Devuyst O, Gansevoort RT, Grantham JJ, Higashihara E, Perrone RD, Krasa HB, Ouyang J, Czerwiec FS; TEMPO 3:4 Trial Investigators. Tolvaptan in patients with autosomal dominant polycystic kidney disease. N Engl J Med. 2012 Dec 20;367(25):2407-18.
- Gralla RJ, Ahmad F, Blais JD, Chiodo J 3rd, Zhou W, Glaser LA, Czerwiec FS. Tolvaptan use in cancer patients with hyponatremia due to the syndrome of inappropriate antidiuretic hormone: a post hoc analysis of the SALT-1 and SALT-2 trials. Cancer Med. 2017 Apr;6(4):723-729.
- https://ec.europa.eu/health/documents/community-register/2014/20140619128911/anx_128911_it.pdf