Dettagli
- Definizione
- Epidemiologia
- Eziologia e patogenesi
- Immagine01
- Immagine 02
- Terapia
- Immagine 03
- Complicazioni
- Prognosi
- Immagine 04
11.03 – [11.03 – Trombosi profonda e Superficiale (TVP e TVS)] Trombosi venosa profonda e superficiale
Definizione
- La TVP è una condizione causata da un coagulo che ostruisce il flusso sanguigno nel sistema venoso profondo e che si verifica più comunemente nelle gambe. In genere essa può essere provocata da fattori come un recente intervento chirurgico o un trauma, un’ospedalizzazione con riposo a letto prolungato o l’uso di contraccettivi orali. Al contrario, una TVP non provocata può essere idiopatica o derivare da stati di ipercoagulabilità ereditati o acquisiti come cancro e gravidanza.
- L’incidenza aumenta con l’età ed è annualmente stimata in tutto il mondo di circa 10 milioni. I fattori di rischio possono essere transitori o persistenti e possono aumentare additivamente o sinergicamente il rischio trombotico causando danni o disfunzioni della parete vascolare, stasi o ipercoagulabilità del sangue (triade di Virchow).
- I fattori di rischio che influenzano maggiormente l’integrità vascolare (inducendo un danno o una disfunzione della parete dei vasi) includono la chirurgia maggiore, il trauma/frattura e il posizionamento del catetere venoso centrale.
- I fattori di rischio che influenzano maggiormente la velocità del flusso sanguigno (stasi venosa) includono: obesità, riposo a letto, malattia neurologica con paresi delle gambe, lunghi viaggi aerei (> 4-6 ore), sindrome dell’uscita toracica venosa (sindrome di Paget-Schroetter) e sindrome di May-Thurner.
- I fattori di rischio che influenzano maggiormente l’ipercoagulabilità del sangue includono l’età avanzata, il cancro attivo, la storia familiare di tromboembolia venosa (TEV), la gravidanza, i contraccettivi orali, la terapia ormonale, le condizioni infiammatorie come la sindrome di Behcet e la sindrome da anticorpi antifosfolipidi, la trombocitopenia indotta da eparina, la coagulazione intravascolare disseminata e la trombofilia ereditata.
- È importante riconoscere che molti fattori di rischio influenzano più di un aspetto della triade di Virchow. Per esempio, la chirurgia provoca danni vascolari, coagulazione attivata e immobilizzazione, mentre l’obesità è associata sia alla stasi venosa che all’ipercoagulabilità del sangue.
- Tipi di TVP degli arti inferiori:
- la TVP distale si riferisce ad una forma confinata alle vene profonde sotto il ginocchio; rispetto alla TVP prossimale essa è associata a tassi inferiori di recidiva, embolia polmonare e sviluppo della sindrome post-trombotica;
- la TVP prossimale è la forma più comune e si estende nella vena poplitea o più prossimalmente;
- la TVP iliofemorale è caratterizzata dalla trombosi parziale o completa delle vene iliache o femorali comuni con o senza coinvolgimento di altre vene degli arti inferiori o della vena cava inferiore; rispetto alla TVP prossimale essa è inoltre associata a sintomi più gravi, a un maggior rischio di TEV ricorrente ed a una maggiore gravità della sindrome post-trombotica.
- La TVP è causata da un coagulo di sangue nel sistema venoso profondo che causa l’ostruzione del flusso; si verifica più spesso nelle gambe ma può svilupparsi anche nelle estremità superiori, nelle vene splancniche e nelle vene cerebrali.
- La tromboembolia venosa (VTE) si manifesta come TVP e/o embolia polmonare e si verifica più comunemente nelle gambe ma può verificarsi anche nelle braccia, nelle vene splancniche e in quelle cerebrali.
- Una TVP provocata è causata da un chiaro fattore scatenante, tra cui:
- fattori transitori (fattori di rischio che si risolvono dopo l’incidenza del TEV provocato); questi includono fattori incitanti transitori importanti che si verificano durante i 3 mesi precedenti la diagnosi; questi sono considerati “maggiori” se associati a:
- metà del rischio di TEV ricorrente dopo la fine della terapia anticoagulante rispetto a nessun fattore di rischio transitorio;
- rischio 10 volte maggiore di avere il primo TEV; alcuni esempi di grandi fattori scatenanti transitori sono: chirurgia con anestesia generale della durata di > 30 minuti; degenza in ospedale ≥ 3 giorni con malattia acuta; parto cesareo;
- fattori scatenanti transitori minori che si verificano durante i 2 mesi precedenti la diagnosi; essi sono considerati “minori” se associati a:
- metà del rischio di TEV ricorrente dopo la fine della terapia anticoagulante rispetto a nessun fattore di rischio transitorio;
- aumento da 3 a 10 volte del rischio di avere il primo TEV; esempi di fattori scatenanti transitori minori sono: chirurgia con anestesia generale per < 30 minuti, ricovero per < 3 giorni con malattia acuta, terapia estrogenica, gravidanza o puerperio, degenza a letto fuori dall’ospedale ≥ 3 giorni con malattia acuta e mobilità ridotta a causa di una lesione alla gamba ≥ 3 giorni;
- fattori di rischio persistenti:
- includono condizioni croniche che sono note per aumentare il rischio di TEV; anche il cancro attivo è considerato un fattore di rischio persistente se: nessun trattamento potenzialmente curativo è stato somministrato; nessuna prova che il trattamento sia stato curativo (per esempio, recidiva o progressione della malattia) oppure con trattamento in corso;
- altri fattori di rischio persistenti non cancerogeni associati ad un aumento di 2 volte del rischio di TEV ricorrente dopo la fine della terapia anticoagulante includono condizioni associate a malattie infiammatorie croniche come la malattia infiammatoria intestinale, le malattie autoimmuni e le infezioni croniche.
- fattori transitori (fattori di rischio che si risolvono dopo l’incidenza del TEV provocato); questi includono fattori incitanti transitori importanti che si verificano durante i 3 mesi precedenti la diagnosi; questi sono considerati “maggiori” se associati a:
- Una TVP non provocata non è invece scatenata da fattori di rischio transitori o persistenti.
- TVP massiccia:
- caratterizzata da un forte dolore, gonfiore dell’intero arto, acrocianosi; un’ischemia degli arti può verificarsi nei casi più gravi;
- coinvolge la vena iliofemorale e può estendersi nella vena cava inferiore;
- vena femorale superficiale:
- termine inappropriato che non è riconosciuto anatomicamente ma è stato usato frequentemente nei referti duplex venosi degli arti inferiori;
- la vena femorale superficiale è una vena profonda e la trombosi deve essere trattata come TVP;
- sindrome post-trombotica (PTS):
- blocco persistente del flusso sanguigno risultante dalla risoluzione e/o guarigione incompleta di una TVP;
- i sintomi includono dolore cronico alle gambe, gonfiore, arrossamento e talvolta ulcere.
- La TVP distale (nota anche come TVP del polpaccio):
- con l’acronimo di IDDVT si riferisce alle vene profonde sotto il ginocchio che includono: vene peroneali appaiate; vena tibiale posteriore; vena tibiale anteriore;
- può anche includere TVP in 2 gruppi di vene muscolari (trombosi muscolare isolata del polpaccio, ICMVT):
- vene del muscolo soleo collegate alle vene tibiali o peroneali posteriori o vene del muscolo gastrocnemio che drenano nella vena poplitea;
- non è chiaro se la ICMVT debba essere distinta dalla IDDVT o se entrambe debbano essere considerate TVP distali nel loro insieme:
- lo studio OPTIMEV non ha trovato differenze nei fattori di rischio (a parte un intervento chirurgico recente [≤ 45 giorni]) o nella mortalità, nella ricorrenza del tromboembolismo venoso (TEV) e nel sanguinamento maggiore a 3 mesi tra ICMVT e IDDVT;
- la decima edizione delle linee guida dell’American College of Chest Physicians (ACCP) sulla terapia antitrombotica per il TEV considera la ICMVT a minor rischio di estensione rispetto alla IDDVT;
- la TVP distale ha un’incidenza del 20% di tutte le TVP diagnosticate (fino al 60%-70% nei pazienti ambulatoriali diagnosticati tramite ecografia compressiva);
- il ruolo della terapia anticoagulante è discusso, in quanto l’1%-5,7% dei casi sembra estendersi prossimalmente se non trattato;
- rispetto alla TVP prossimale, la forma distale è associata a tassi inferiori di embolia polmonare, recidive e sindrome post-trombotica.
- TVP prossimale:
- con un’incidenza di circa l’80%, la parte più alta del trombo si estende nella vena poplitea (formata dalla triforcazione delle vene peroneale, tibiale posteriore e tibiale anteriore) o più prossimalmente;
- si pensa che la maggior parte delle TVP sintomatiche abbia inizio nel polpaccio ed il trattamento consta nella terapia anticoagulante.
- TVP iliofemorale:
- sottotipo di TVP prossimale che rappresenta circa ¼ dei casi e coinvolge la trombosi parziale o completa delle vene iliache o femorali comuni con o senza coinvolgimento di altre vene degli arti inferiori o della vena cava inferiore;
- rispetto alla TVP prossimale (femoropoplitea) è meno estesa e può essere associata a: grave dolore e gonfiore alle gambe, ischemia degli arti, aumento del rischio di TEV ricorrente ed aumento della gravità della sindrome post-trombotica;
- il cardine del trattamento è l’anticoagulazione, anche se possono essere considerate misure aggiuntive come la terapia trombolitica e la trombectomia.
Epidemiologia
- Il tromboembolismo venoso è più comunemente osservato con l’aumentare dell’età e negli uomini più che nelle donne, anche se quest’ultimo aspetto non è chiaro in quanto in giovane età gli individui di sesso femminile sembrano essere più a rischio degli uomini; inoltre, nei pazienti neri rispetto a quelli bianchi (meno comunemente tra i pazienti asiatici e ispanici) i risultati possono essere confusi da altri fattori come le differenze regionali nelle condizioni di comorbidità, l’esposizione a fattori di rischio ambientali e la qualità delle cure mediche.
- Come incidenza su base mondiale la TEV è stimata a 10 milioni di casi all’anno, di cui circa due terzi dei pazienti hanno riferito di presentarsi con sospetta TVP e circa un terzo ha riferito di presentarsi con sospetta embolia polmonare. Inoltre: circa il 90% ha riferito un coinvolgimento della gamba; il 5% ha riferito di coinvolgere le braccia (o più vene centrali); il 5% ha riferito di coinvolgere siti venosi profondi insoliti (come vene viscerali o cerebrali); tre quarti dei TEV sono segnalati come primi episodi e un quarto come recidive.
- La distinzione della TVP delle gambe include:
- TVP distale:
- riportato nel 20% di tutte le TVP diagnosticate (fino al 60%-70% nei pazienti ambulatoriali diagnosticati da ecografia di compressione);
- prevalenza riportata: 4%-15% tra i pazienti con sospetto di TVP; 7%-11% tra i pazienti con sospetto di PE; 23%-59% tra i pazienti con diagnosi di TVP;
- TVP prossimale:
- riportata nell’80% di tutte le TVP diagnosticate; la TVP iliofemorale rappresenta circa un quarto di tutti i casi;
- su 387 pazienti (età media 56 anni) con diagnosi di TVP acuta sintomatica, 233 pazienti (60%) avevano TVP prossimale; tra di essi: vena femorale superficiale nel 34%; vena femorale comune nel 33%; vena poplitea nel 27%; vena iliaca nel 6%.
- TVP distale:
- L’incidenza della TEV aumenta con l’età, salendo fino a 1 caso su 100 persone all’anno riportato per individui di età > 80 anni; inoltre il rischio di sviluppare una TVP nel corso della vita per gli individui di età > 45 anni è stato riportato all’8%.
- Il tasso annuale di incidenza aggiustato per età varia a seconda del sesso secondo uno studio del Minnesota:
- 130 per 100.000 uomini;
- 110 per 100.000 donne.
- L’incidenza annuale di TEV varia a seconda della regione geografica e dell’età della popolazione in una revisione sistematica su 29 studi, per cui l’incidenza annuale di TEV è dello 0,75-2,69 casi per 1.000 individui in Europa occidentale, Nord America, Australia e Argentina; 0,08-0,16 casi per 1.000 individui in Asia orientale; 2-7 per casi 1.000 individui di età ≥ 70 anni. L’ incidenza annuale di TVP invece si stima attorno allo 0,4-1,55 per 1.000 individui in Europa occidentale, Nord America, Australia e Argentina; 0,05-0,171 per 1.000 individui in Asia orientale.
- Secondo uno studio su 144.952 individui (età ≥ 19 anni) in Scandinavia senza precedente TVP o cancro durante un follow-up di circa 11,7 anni l’incidenza di TEV è dell’1,4 per 1.000 persone (2.444 casi nel complesso); 0,3 per 1.000 persone tra gli individui di età compresa tra 20 e 29 anni; 6,4 per 1.000 persone tra gli individui di età ≥ 80 anni; la TVP ha rappresentato 1.417 casi (58% VTE) e PE ha rappresentato 993 casi (40,6%).
- Tra gli iscritti a Medicaid (età ≥ 18 anni) negli Stati Uniti dal 2002 al 2005 (media di 4,5 milioni di iscritti idonei all’analisi per anno):
- TEV diagnosticato in 46.652 pazienti (età media alla diagnosi 47,2 anni), di cui: DVT nel 72,2%; PE nel 22,5%; sia DVT che PE nel 5,3%; la prevalenza globale di TEV si attesta tra: 276 per 100.000 iscritti nel 2002 e 358 per 100.000 iscritti nel 2005;
- La prevalenza di TEV per razza nel 2005 è: 784 per 100.000 maschi afroamericani; 643 per 100.000 maschi bianchi; 446 per 100.000 donne bianche; 444 per 100.000 donne afroamericane; 297 per 100.000 donne iscritte di altra razza; 285 per 100.000 iscritti maschi di altra razza; 154 per 100.000 donne ispaniche; 149 per 100.000 maschi ispanici.
Eziologia e patogenesi
- I trombi venosi sono descritti come “coaguli rossi” a causa del loro alto contenuto di eritrociti; sono anche arricchiti in fibrina e contengono leucociti e piastrine. La trombosi venosa negli arti inferiori si verifica tipicamente nelle “tasche” tra i lembi delle valvole. Esse sono più numerose nelle estremità inferiori dove il ritorno del sangue opera contro la gravità ed inoltre:
- guidano la direzione del flusso sanguigno aiutando a promuovere il flusso attraverso la circolazione venosa ed a prevenire il reflusso;
- sono suscettibili alla formazione di trombi a causa dell’ ipercoagulabilità causata da: diminuzione della velocità del flusso sanguigno attraverso le valvole; sangue ipossico nelle cuspidi valvolari; aumento dell’ematocrito all’interno delle tasche valvolari; tendenza dei leucociti e delle piastrine a rimanere intrappolati nella tasca della valvola.
- Il fattore tissutale è necessario per iniziare la formazione di trombi; la sua fonte d’inizio è dibattuta, ma alcune possibilità includono: cellule endoteliali; cellule avventizie della parete dei vasi; leucociti (specialmente monociti); microparticelle derivate dai leucociti.
- Lo sviluppo del tromboembolismo venoso si verifica a causa di alterazioni nella triade di Virchow, che consiste in: cambiamenti nell’integrità vascolare (danno o disfunzione endoteliale); diminuzione della velocità del flusso sanguigno (stasi venosa); ipercoagulabilità (quando l’attività procoagulante è maggiore dell’attività anticoagulante naturale); inoltre i componenti della triade di Virchow sono interconnessi, quindi:
- la stasi all’interno delle tasche valvolari provoca una minore evacuazione dei fattori di coagulazione attivati che porta all’ipercoagulabilità;
- la stasi (e la conseguente ipossia) attiva l’endotelio, portando a: una minore attivazione di alcune proteine antitrombotiche che sono espresse preferenzialmente sulle valvole venose tra cui la trombomodulina e il recettore della proteina C endoteliale; attivazione del fattore tissutale (anche se l’endotelio come fonte di fattore tissutale è incerto); attivazione della P-selectina che porta al reclutamento di leucociti o microparticelle di leucociti contenenti fattore tissutale;
- più di 2 alterazioni nella triade di Virchow sono tipicamente necessarie per lo sviluppo di un trombo clinicamente significativo;
- i fattori di rischio per la TVP comportano cambiamenti nella triade di Virchow come:
- l’immobilizzazione comporta una riduzione del flusso sanguigno venoso nelle estremità inferiori con una massima stasi che si verifica nelle tasche delle valvole;
- una neoplasia maligna può: portare alla compressione delle vene che a sua volta porta alla stasi; essere associata all’espressione di fattori procoagulanti da parte delle cellule tumorali; portare al rilascio di procoagulanti come il fattore tissutale sulle particelle di membrana che promuove la trombosi;
- l’avanzare dell’età è associata a: maggiore prevalenza di comorbidità che aumentano il rischio di TVP, tra cui cancro, immobilità, ospedalizzazione e chirurgia; aumento dei livelli di procoagulanti senza aumenti concomitanti degli anticoagulanti naturali come la proteina C;
- la gravidanza è associata a:
- stasi venosa causata da: venodilatazione indotta dal progesterone; compressione venosa pelvica da parte dell’utero gravidico; compressione pulsatile della vena iliaca sinistra da parte dell’arteria iliaca destra che porta alla marcata propensione alla TVP della gamba sinistra in gravidanza;
- l’ipercoagulabilità comprende: ridotta attività anticoagulante della proteina S e aumento della resistenza della proteina C attivata; aumento dell’attività procoagulante attraverso livelli elevati di fibrinogeno e fattore V, VIII, IX e X; ridotta fibrinolisi dovuta all’aumento dell’attività dell’inibitore dell’attivatore del plasminogeno di tipo 1 e 2 (PAI-1 e 2) e alla diminuzione dell’attività dell’attivatore del plasminogeno tissutale (t-PA);
- il periodo post-partum è associato a: danni vascolari ai vasi pelvici che possono verificarsi dopo un normale parto vaginale, vaginale assistito o cesareo; immobilizzazione; effetti persistenti dell’ipercoagulabilità in gravidanza (soprattutto nel primo periodo postpartum);
- l’obesità può essere associata a: stato infiammatorio cronico, spesso innescato da citochine infiammatorie secrete dagli adipociti e dai macrofagi adiposi localizzati; un eccesso di peso porta alla stimolazione dell’endotelio vascolare, delle piastrine e di altre cellule circolanti, con conseguente attivazione dei fattori procoagulanti come il fattore tissutale e le molecole di adesione ed inibizione delle proteine regolatrici anticoagulanti, aumento della generazione di trombina e maggiore attivazione piastrinica; alterazione della fibrinolisi; fattori di rischio clinico come immobilità, apnea ostruttiva del sonno, insufficienza cardiaca e stasi venosa;
- gli stati genetici ipercoagulabili comportano un’alterazione del rapporto tra procoagulanti e anticoagulanti e un aumento del rischio di formazione di trombi;
- Sindrome di May-Thurner: il restringimento della vena iliaca comune sinistra e le pulsazioni croniche dell’arteria iliaca comune destra sovrastante possono portare alla stasi del ritorno venoso nelle vene degli arti inferiori e alla TVP, più comunemente dell’arto inferiore sinistro; questa sindrome è spesso associata ad altri fattori di rischio come l’immobilizzazione, la disidratazione, la chirurgia, gli ormoni (come la pillola anticoncezionale, il testosterone e gli steroidi) e fattori genetici.
- Nella TVP non si riscontra nessun fattore di rischio identificabile in circa il 25%-40% dei casi di tromboembolismo venoso. I fattori di rischio più probabili includono fattori transitori o persistenti che possono additivamente o sinergicamente causare danni o disfunzioni della parete vascolare, stasi o ipercoagulabilità; tra di essi abbiamo:
- chirurgia: possibile responsabile di circa il 15% dei casi, in particolare per i pazienti che subiscono un intervento ortopedico maggiore con tassi postoperatori di circa l’1% riportati nonostante la tromboprofilassi farmacologica;
- immobilizzazione (circa il 15% dei casi);
- cancro (circa il 20% di tutti i casi).
- I fattori di rischio per la TVP comportano cambiamenti nella triade di Virchow, che colpiscono soprattutto l’integrità vascolare (danno o disfunzione endoteliale); ad esempio:
- interventi di neurochirurgia, chirurgia ortopedica maggiore della gamba, chirurgia toracica, addominale o pelvica per il cancro, chirurgia cardiovascolare o trapianto renale, specie nei pazienti sopra i 65 anni;
- traumi/fratture;
- catetere venoso centrale o pacemaker transvenoso;
- tra i fattori di rischio che influenzano soprattutto la velocità del flusso sanguigno (stasi venosa) abbiamo:
- ricovero per patologia acuta, specialmente in pazienti con: età avanzata; obesità; precedente TEV; trombofilia ereditaria, compresa la mutazione del fattore V Leiden, la mutazione del gene della protrombina, la deficienza della proteina S o della proteina C e la deficienza dell’antitrombina; cancro; trauma o intervento chirurgico recente; tachicardia; infarto miocardico acuto o ictus; paresi delle gambe; insufficienza cardiaca; immobilizzazione prolungata (riposo a letto); infezione acuta o disturbo reumatologico; terapia ormonale; catetere venoso centrale; ricovero in unità di terapia intensiva o coronarica; aumentato numero di globuli bianchi e piastrine; obesità; degenza in casa di cura; vene varicose; malattia neurologica con paresi delle gambe; lunghi viaggi aerei (> 4-6 ore); apnea ostruttiva del sonno; sindrome di Paget-Schroetter; Sindrome di May-Thurner:
- compressione estrinseca della vena iliaca comune sinistra da parte dell’arteria iliaca comune destra (a livello della posizione di incrocio) contro strutture ossee (di solito vertebre lombari inferiori);
- provoca un’ostruzione/stenosi del deflusso venoso e un’ipertensione venosa nell’arto omolaterale e un aumento del rischio di TVP prossimale sinistra estesa; la sindrome è più comune nelle donne e riportata nel 18%-49% dei pazienti che presentano una TVP dell’arto inferiore sinistro;
- ricovero per patologia acuta, specialmente in pazienti con: età avanzata; obesità; precedente TEV; trombofilia ereditaria, compresa la mutazione del fattore V Leiden, la mutazione del gene della protrombina, la deficienza della proteina S o della proteina C e la deficienza dell’antitrombina; cancro; trauma o intervento chirurgico recente; tachicardia; infarto miocardico acuto o ictus; paresi delle gambe; insufficienza cardiaca; immobilizzazione prolungata (riposo a letto); infezione acuta o disturbo reumatologico; terapia ormonale; catetere venoso centrale; ricovero in unità di terapia intensiva o coronarica; aumentato numero di globuli bianchi e piastrine; obesità; degenza in casa di cura; vene varicose; malattia neurologica con paresi delle gambe; lunghi viaggi aerei (> 4-6 ore); apnea ostruttiva del sonno; sindrome di Paget-Schroetter; Sindrome di May-Thurner:
- tra i fattori di rischio che influenzano maggiormente l’ipercoagulabilità ricordiamo: età > 55 anni o più avanzata; cancro attivo con o senza chemioterapia concomitante; storia familiare di TEV; precedente trombosi venosa superficiale; gravidanza e periodo postpartum (rischio riportato circa 4 volte superiore rispetto alle donne non incinte in età fertile o in gravidanza); contraccettivi orali:
- rischio più alto con i contraccettivi orali di prima e terza generazione rispetto ai contraccettivi orali di seconda generazione; anche il depot-medrossiprogesterone acetato iniettabile per la contraccezione è stato segnalato come associato a un rischio 3 volte maggiore di TEV, mentre il dispositivo intrauterino al levonorgestrel non è segnalato come associato al rischio;
- terapia ormonale: è associata ad un aumento di 2-4 volte del rischio di TEV e il rischio può variare in base al tipo di estrogeno; la terapia estrogenica transdermica può non essere associata al rischio;
- condizioni infiammatorie come: Sindrome di Behcet; malattia celiaca; malattia infiammatoria intestinale; artrite reumatoide; tromboangioite obliterante (malattia di Buerger); granulomatosi con poliangioite; sindrome da anticorpi antifosfolipidi;
- trombocitopenia indotta da eparina (HIT);
- disturbi mieloproliferativi (specialmente policitemia rubra vera e trombocitemia essenziale);
- coagulazione intravascolare e fibrinolisi/coagulazione intravascolare disseminata (ICF/DIC); porpora trombotica trombocitopenica; falcemia; emoglobinuria parossistica notturna; aumento dei D-dimeri di fibrina nel plasma al basale;
- sindrome nefrosica;
- ipertiroidismo;
- malattia renale cronica con velocità di filtrazione glomerulare gravemente ridotta;
- anemia emolitica autoimmune (specie nei pazienti con emolisi attiva);
- omocistinuria e iperomocisteinemia;
- fattori di rischio ereditabili: mutazione del fattore V Leiden; mutazione della protrombina G20210A; carenza di antitrombina; carenza di proteina C; carenza di proteina S; gruppo sanguigno non-O; disfibrinogenemia.
- Il calcolatore del rischio di trombosi “QThrombosis” predice il rischio di tromboembolia venosa (VTE) a 1 e 5 anni nei pazienti di assistenza primaria; inoltre, i fattori di rischio per il TEV nei pazienti chirurgici includono la gravidanza o il post-partum, la sepsi recente, tumori maligni, il precedente TEV e l’accesso venoso centrale; il punteggio di rischio di Rogers sembra predire il rischio di TEV postoperatorio dopo la chirurgia generale e vascolare, mentre il punteggio di rischio Caprini può predire il rischio di TEV in pazienti con chirurgia plastica e ricostruttiva senza chemioprofilassi.
Immagine01
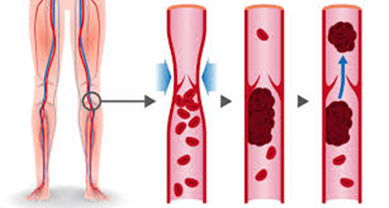
- La TVP può essere asintomatica e la diagnosi può essere fatta accidentalmente durante un esame diagnostico per altri scopi. Segni e sintomi della TVP hanno una scarsa specificità, quindi ad esempio solo circa la metà dei pazienti con tensione muscolare ha una trombosi confermata; inoltre la sintomatologia appare più evidente nei pazienti ambulatoriali rispetto ai pazienti ospedalizzati e post-operatori che alla fine si dimostrano avere una TVP (segni clinici riportati solo in circa il 25% tra i pazienti ospedalizzati). I sintomi sono utili per: determinare la probabilità pretest di TVP; stratificare i pazienti con sospetto di TVP in base al rischio; guidare nella decisione di sottoporre il paziente ad ulteriori indagini immagistiche o un test dei D-dimeri.
- La TVP dovrebbe essere sospettata nei pazienti che presentano gonfiore, dolore, calore o eritema inspiegabili alle estremità. I pazienti con TVP della gamba possono anche presentare sintomi come: crampi e pesantezza, soprattutto al polpaccio; aumento visibile delle vene; scolorimento blu-rosso o cianotico; gonfiore o edema pitting del polpaccio colpito rispetto al polpaccio asintomatico; sensibilità della gamba; vene superficiali collaterali; sensibilità delle vene nella regione poplitea (segno di Pratt) o dolore nella regione poplitea all’estensione del ginocchio (segno di Sigg); segno di Homans (dolore durante la dorsiflessione del piede), quantificato utilizzando uno sfigmomanometro per misurare la pressione che provoca il dolore (test di Lowenberg); febbre bassa inspiegabile (segno di Michaeli) con aumento della frequenza cardiaca (segno di Mahler).
- La trombosi iliofemorale può presentarsi con: dolore alle natiche o all’inguine; gonfiore nella coscia; vene superficiali collaterali; phlegmasia cerulea dolens, che può essere indicata dalla presenza di: forte dolore, edema massivo, cianosi, mancanza di pulsazioni arteriose, bolle cutanee, gangrena evidente.
- Circa un terzo dei pazienti con TVP sintomatica ha riferito di avere una concomitante PE silenziosa, mentre circa il 70% dei pazienti con TVP sintomatica ha riferito di avere una TVP concomitante (di cui circa il 25% è sintomatico); i sintomi di una PE includono: insorgenza improvvisa di dispnea o peggioramento della dispnea esistente; dolore al petto (pleuritico o substernale, simile all’angina); presincope o sincope; tosse con o senza emottisi.
- I segni di PE includono: tachicardia (> 100 battiti/minuto); tachipnea (> 20 respiri/minuto); sfregamento pleurico; diminuzione dei suoni del respiro; crepitii all’auscultazione polmonare; ipotensione arteriosa e shock con PE massiva; segni di ipertensione polmonare (come forte suono di chiusura della valvola polmonare, ritmo di galoppo sul lato destro e distensione delle vene del collo).
- L’obiettivo della valutazione dei pazienti con sospetto clinico di TVP della gamba è quello di determinare la necessità di una terapia anticoagulante come mezzo per prevenire l’estensione del trombo o l’embolizzazione, evitando al contempo ulteriori test inutili.
- Per i pazienti ambulatoriali con sospetto primo epiSodio TVP considerare l’uso di una regola di predizione standardizzata per determinare il rischio prima di ogni accertamento; il percorso diagnostico suggerito varia con la probabilità clinica di effettuare dei pre-test; per i pazienti sospettati di avere una prima TVP dell’arto inferiore, se ambulatoriali e con bassa probabilità di pretest, eseguire i D-dimeri o l’ecografia di compressione piuttosto che nessun test diagnostico, venografia, o ecografia della gamba intera; se il test del D-dimero è negativo, non si raccomandano altri test, mentre se è positivo, è suggerita un’ecografia a compressione delle vene prossimali oppure un’ecografia della gamba intera. Se l’ecografia di compressione prossimale è negativa non si raccomandano altri test, mentre se positiva si può passare direttamente al trattamento della TVP.
- Per i pazienti ambulatoriali con moderata probabilità di pretest si può iniziare eseguendo i D-dimeri altamente sensibili, l’ecografia di compressione prossimale o l’ecografia della gamba intera; preferendo i D-dimeri altamente sensibili rispetto all’ecografia dunque, se questi risultano negativi non si raccomandano altri test, mentre se positivi si può eseguire un’ecografia di compressione prossimale o un’ecografia della gamba intera. Se l’ecografia di compressione prossimale è stata invece scelta come test iniziale ed è negativa:
- ripetere l’ecografia di compressione in 1 settimana o eseguire un test dei D-dimeri moderati o altamente sensibili piuttosto che nessun ulteriore test o venografia; se i D-dimeri sono positivi, ripetere l’ecografia di compressione prossimale in 1 settimana; se l’ecografia di compressione o i D-dimeri sono negativi, si raccomanda di non effettuare ulteriori test;
- se l’ecografia di compressione prossimale è positiva, trattare per DVT;
- se l’ecografia della gamba intera è negativa, non si raccomandano ulteriori test; se invece positiva per TVP distale isolata, considerare ulteriori indagini per escludere l’estensione prossimale durante il trattamento;
- per i pazienti ambulatoriali con alta probabilità di pretest:
- inizialmente è possibile eseguire un’ecografia di compressione prossimale o un’ecografia della gamba intera piuttosto che nessun test o una venografia;
- se l’ecografia iniziale di compressione prossimale è negativa eseguire i D-dimeri altamente sensibili, l’ecografia della gamba intera o ripetere l’ecografia di compressione prossimale in 1 settimana piuttosto che nessun ulteriore test o venografia; se il test dei D-dimeri è invece positivo, l’ecografia della gamba intera o la ripetizione dell’ecografia di compressione prossimale in 1 settimana sono raccomandate rispetto a nessun ulteriore test o alla venografia; se dunque l’ecografia di compressione prossimale seriale o il test dei D-dimeri sono negativi, non si raccomandano ulteriori test; se l’ecografia di compressione prossimale è invece positiva, trattare per DVT; infine, quando l’ecografia della gamba intera è negativa non si raccomandano ulteriori test, mentre se positiva, trattare la TVP.
Immagine 02
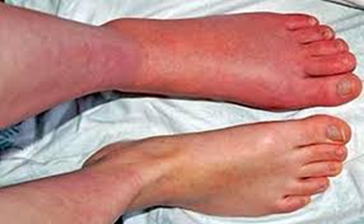
- Per i pazienti con sospetta TVP ricorrente si può iniziare eseguendo un’ecografia di compressione prossimale o un test dei D-dimeri altamente sensibili oppure una venografia con contrasto CT o una MRI. Se i D-dimeri sono negativi, non si raccomandano ulteriori test, mentre se positivi si può eseguire un’ecografia di compressione prossimale o una venografia CT o una MRI.
- Se si sospetta una TVP omolaterale ricorrente con un’ecografia anormale precedente e se l’ecografia di compressione prossimale è negativa (normale o aumento del diametro residuo di < 2 mm), considerare la ripetizione dell’ecografia dopo circa 1 settimana o l’esecuzione di un test dei D-dimeri moderatamente o altamente sensibili seguito da una ripetizione dell’ecografia di compressione prossimale. Se l’ecografia di compressione prossimale seriale o i D-dimeri sono negativi, non si raccomandano ulteriori test. Se invece l’ecografia di compressione prossimale è anormale ma non si qualifica come recidiva (aumento del diametro venoso residuo di 2-4 mm), si raccomandano ulteriori test come: venografia, se disponibile, ecografia seriale di compressione prossimale in 1 settimana, test dei D-dimeri moderatamente o altamente sensibili, poi ultrasuoni seriali di compressione prossimale se positivi; un’ulteriore ecografia di compressione prossimale intorno al secondo giorno può essere utile in aggiunta all’ecografia alla prima settimana; se l’ecografia di compressione prossimale trova:
- nuovo segmento non comprimibile nella vena femorale comune o poplitea, trattare per TVP;
- ≥ 4 mm di aumento del diametro venoso durante la compressione rispetto allo stesso segmento venoso su un test precedente, considerare il trattamento per TVP;
- se si sospetta una TVP omolaterale ricorrente con un’ecografia anormale, in assenza di un risultato precedente per il confronto, piuttosto che un’ecografia di compressione prossimale seriale si raccomandano ulteriori test come la venografia, se disponibile, o il test dei D-dimeri altamente sensibili; se quest’ultimo risulta negativo, nessun ulteriore test è suggerito, mentre, se positivo, la venografia va preferita rispetto al trattamento empirico della recidiva.
- Se si sospetta una TVP omolaterale ricorrente con un’ecografia anormale precedente e se l’ecografia di compressione prossimale è negativa (normale o aumento del diametro residuo di < 2 mm), considerare la ripetizione dell’ecografia dopo circa 1 settimana o l’esecuzione di un test dei D-dimeri moderatamente o altamente sensibili seguito da una ripetizione dell’ecografia di compressione prossimale. Se l’ecografia di compressione prossimale seriale o i D-dimeri sono negativi, non si raccomandano ulteriori test. Se invece l’ecografia di compressione prossimale è anormale ma non si qualifica come recidiva (aumento del diametro venoso residuo di 2-4 mm), si raccomandano ulteriori test come: venografia, se disponibile, ecografia seriale di compressione prossimale in 1 settimana, test dei D-dimeri moderatamente o altamente sensibili, poi ultrasuoni seriali di compressione prossimale se positivi; un’ulteriore ecografia di compressione prossimale intorno al secondo giorno può essere utile in aggiunta all’ecografia alla prima settimana; se l’ecografia di compressione prossimale trova:
- I pazienti ospedalizzati con sospetta TVP dovrebbero essere testati con un’ecografia intera della gamba e le regole di previsione clinica non sono state ampiamente convalidate nei pazienti ospedalizzati; inoltre le strategie diagnostiche possono variare nei pazienti con sospetta prima TVP senza stratificazione del rischio, nei pazienti con cancro e nelle donne in gravidanza. Una volta formulata la diagnosi possono essere richiesti ulteriori test per guidare la terapia e identificare altre condizioni sottostanti, come i valori ematologici di base, i test per la trombofilia e lo screening per il cancro.
Terapia
- L’obiettivo del trattamento della TVP è quello di prevenire le recidive, lo sviluppo di complicazioni come l’embolia polmonare (PE) e la sindrome post-trombotica, limitando il rischio di sanguinamento. In caso di sopraggiunta di una PE il trattamento diventa mirato alla cura dell’embolia. Le linee guida per il trattamento variano in base al tipo di TVP, che include la TVP distale isolata, la TVP prossimale e la TVP iliofemorale.
- Per quanto riguarda la terapia per la TVP distale isolata acuta i benefici della terapia anticoagulante non sono chiari a causa del basso rischio di TVP progressiva o ricorrente. Per i pazienti con sintomi gravi o fattori di rischio per l’estensione, considerare l’anticoagulazione rispetto allo studio diagnostico ripetuto delle vene profonde, che è invece consigliato per i pazienti senza sintomi gravi o fattori di rischio, per 2 settimane insieme alla terapia anticoagulante. Se si decide di trattare con anticoagulanti la dose deve essere la stessa dei soggetti con TVP prossimale acuta, mentre se la decisione è di gestire con tecniche radiologiche:
- non anticoagulare se il trombo non si estende;
- considerare invece l’anticoagulazione se il trombo si estende ma rimane nelle vene distali; trattare con anticoagulante se il trombo si estende nelle vene prossimali.
- Per quanto riguarda la terapia anticoagulante:
- se la TVP distale isolata è provocata da un intervento chirurgico o da un fattore di rischio transitorio diverso dall’intervento:
- considerare l’anticoagulazione per 3 mesi;
- somministrare l’anticoagulazione per 3 mesi su un periodo di tempo più lungo (per esempio, 6, 12 o 24 mesi) o una terapia estesa;
- se la TVP distale isolata non è provocata, trattare con anticoagulazione per 3 mesi o un periodo più lungo limitato nel tempo (per esempio, 6, 12 o 24 mesi).
- se la TVP distale isolata è provocata da un intervento chirurgico o da un fattore di rischio transitorio diverso dall’intervento:
- Le linee guida di trattamento per pazienti con TVP prossimale (iliofemorale e femoro-poplitea) raccomandano di trattare con anticoagulanti a lungo termine (3 mesi). La scelta dell’anticoagulazione a lungo termine o permanente (nessuna data di arresto programmata), per i pazienti senza cancro, consta nell’assunzione di dabigatran, rivaroxaban, apixaban o edoxaban (senza ordine di preferenza) rispetto agli antagonisti della vitamina K. Quando quest’ultimi non sono indicati si privilegiano gli anti-vitamina-K all’eparina a basso peso molecolare. Se è necessaria una terapia prolungata, la scelta dell’anticoagulante non deve essere cambiata dopo 3 mesi.
- Per quanto riguarda la durata della terapia anticoagulante, se la TVP prossimale è provocata da un intervento chirurgico, trattare con anticoagulazione per un periodo che varia dai 3 mesi fino ad un periodo più lungo (per esempio, 6, 12, 24 mesi o una terapia estesa).
- Se invece la causa della TVP è un fattore transitorio diverso dalla chirurgia, è possibile:
- trattare con anticoagulazione per 3 mesi o più;
- dosare lentamente la terapia nei 3 mesi se il rischio di sanguinamento è elevato; considerare invece l’anticoagulazione per 3 mesi o più se il rischio di sanguinamento è basso o moderato.
- Se la TVP prossimale non è stata provocata (ed è stata presa la decisione di somministrare l’anticoagulazione), il bilanciamento del rischio di tromboembolia venosa ricorrente e del rischio di sanguinamento è importante per l’ottimizzazione della durata dell’anticoagulazione; se il rischio di recidiva è maggiore del rischio di sanguinamento, l’anticoagulazione prolungata (> 3 mesi) può essere giustificata. La terapia può essere dosata lentamente durante i 3 mesi o un periodo di tempo più lungo (6, 12 o 24 mesi). Dopo questo periodo devono essere valutati i rischi e i benefici di una terapia prolungata. In generale dunque, per un primo epiSodio di TVP, se c’è un alto rischio di sanguinamento si può somministrare lentamente una terapia anticoagulante per 3 mesi; se il rischio di sanguinamento è basso o moderato, il trattamento può essere esteso oltre i 3 mesi. Se invece il paziente si trova già alla sua prima recidiva, ad un alto rischio di sanguinamento segue una terapia di 3 mesi ed ad un rischio basso o moderato segue un trattamento più esteso.
- Tra le possibili altre terapie enumeriamo:
- in pazienti con TVP prossimale non provocata, considerare l’aspirina come prevenzione delle recidive dopo l’interruzione dell’anticoagulazione, se non controindicata;
- trombolisi catetere-diretta (CDT):
- per i pazienti con TVP acuta della gamba considerare la sola anticoagulazione rispetto alla CDT;
- i pazienti che possono beneficiare della CDT includono quelli con TVP iliofemorale, sintomi per < 14 giorni, buono stato funzionale, basso rischio di sanguinamento e aspettativa di vita ≥ 1 anno;
- il filtro della vena cava inferiore (IVC) non va inserito in pazienti con TVP acuta che ricevono anticoagulanti, mentre è indicato per pazienti con TVP prossimale acuta con controindicazioni all’anticoagulazione; se il filtro IVC è inserito come alternativa all’anticoagulazione, considerare la stessa come terapia se il rischio di sanguinamento si risolve;
- trombectomia venosa operativa:
- considerare l’anticoagulazione rispetto alla trombectomia venosa operativa;
- considerare solo se i pazienti presentano tutti i seguenti elementi: TVP iliofemorale, sintomi per < 7 giorni, buono stato funzionale e aspettativa di vita ≥ 1 anno; per i pazienti che hanno la rimozione della trombosi, offrire la stessa intensità e durata dell’anticoagulazione di quelli che non ne hanno;
- calze compressive: l’uso di routine come prevenzione della sindrome post-trombotica non è suggerito per i pazienti con TVP acuta della gamba;
- altre considerazioni: trattare a casa piuttosto che in ospedale se le circostanze domestiche sono adeguate (il paziente si sente a suo agio, le condizioni di vita sono adeguate, supporto della famiglia o degli amici, accesso al telefono e capacità di tornare rapidamente in ospedale se necessario; considerare la deambulazione precoce piuttosto che il riposo a letto iniziale; per i pazienti con TVP asintomatica considerare la stessa anticoagulazione iniziale ed a lungo termine di quelli con TVP sintomatica.
- Per il trattamento della TVP iliofemorale (IFDVT):
- l’anticoagulazione parenterale oltre i 3 mesi va a tutti i pazienti; per i soggetti senza cancro invece passare al warfarin dopo l’anticoagulazione parenterale iniziale; è anche possibile iniziare la terapia con LMWH per poi passare a dabigatran, rivaroxaban o apixaban dopo 1 settimana;
- interrompere l’anticoagulazione dopo 3 mesi per i pazienti con IFDVT al primo epiSodio legato ad un fattore di rischio reversibile principale; per i pazienti con IFDVT ricorrente o non provocata invece, offrire ≥ 6 mesi di anticoagulazione e considerare un’anticoagulazione permanente con rivalutazione periodica dei rischi e dei benefici;
- considerare 30-40 mm Hg di calze a compressione elastica graduata fino al ginocchio per ≥ 2 anni;
- filtri della vena cava inferiore (IVC): l’uso di routine del filtro IVC per il trattamento dell’IFDVT non è raccomandato; utilizzare il filtro IVC in pazienti adulti con qualsiasi TVP/IFDVT prossimale acuta (o embolia polmonare acuta PE) con controindicazioni all’anticoagulazione o con emorragia attiva; riprendere l’anticoagulazione in pazienti con filtro IVC una volta che le controindicazioni all’anticoagulazione o il sanguinamento attivo si risolvono;
- trombolisi e trombectomia venosa chirurgica: considerare la trombolisi catetere-diretta (CDT) o la trombolisi catetere-diretta farmacomeccanica (PCDT) su pazienti con IFDVT associata a compromissione circolatoria pericolosa per gli arti (come la flemma cerulea dolens);
- considerare la CDT o la PCDT per i pazienti: con IFDVT associata a rapida estensione del trombo nonostante l’anticoagulazione; con deterioramento sintomatico da IFDVT nonostante l’anticoagulazione; come trattamento di prima linea per i pazienti con IFDVT acuta per prevenire la sindrome post-trombotica in pazienti a basso rischio di complicazioni emorragiche;
- l’uso di CDT o PCDT non è suggerito per la maggior parte dei pazienti con sintomi di TVP cronica (> 21 giorni) o pazienti ad alto rischio di complicazioni emorragiche;
- considerare la trombectomia venosa chirurgica: da un chirurgo esperto in pazienti con IFDVT con controindicazioni o fallimento della CDT o per i pazienti con flemma cerulea dolens;
- l’angioplastica venosa percutanea transluminale e stenting (posizionamento di uno stent nella vena iliaca) è indicata per trattare lesioni ostruttive dopo CDT, PCDT o trombectomia venosa chirurgica; si usa anche per ridurre i sintomi della sindrome post-trombotica (PTS) e guarire le ulcere venose in pazienti con PTS avanzata e ostruzione della vena iliaca; si può considerare l’anticoagulazione terapeutica con dosaggio, monitoraggio e durata simili a quelli per i pazienti IFDVT senza stent dopo il posizionamento di uno stent venoso; considerare lo studio di angioplastica percutanea transluminale senza stenting per lesioni ostruttive isolate nella vena femorale comune; considerare la terapia antiaggregante con anticoagulazione concomitente nei pazienti ad alto rischio di ri-trombosi dopo il posizionamento di uno stent venoso; ulteriori considerazioni possono essere necessarie per i pazienti con TVP ricorrente, gravidanza o cancro.
Immagine 03
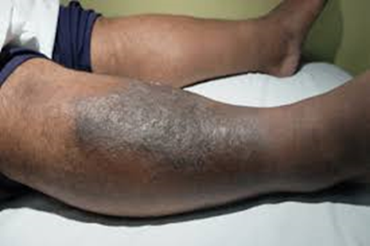
Complicazioni
- Embolia polmonare (PE): secondo uno studio su 5.233 pazienti con TVP, una PE silente è diagnosticata nel 32% dei casi; la PE ricorrente nel 5,1% dei pazienti con PE silente e nello 0,6% dei pazienti senza PE silente;
- la sindrome post-trombotica sembra svilupparsi in circa il 20%-50% dei pazienti con TVP e nel 40% dei pazienti sintomatici entro 2 anni;
- altre complicazioni includono:
- phlegmasia cerulea dolens: è una rara condizione di pericolo per gli arti, tipicamente vista in caso di TVP iliofemorale massiva; è il risultato di un’occlusione trombotica totale o quasi totale del drenaggio venoso, compresi i collateri microvascolari; in questo caso una grave congestione venosa può portare al collasso delle piccole arterie, con conseguente insufficienza arteriosa e ischemia; essa può presentarsi con: forte dolore (può iniziare sopra il triangolo femorale e si diffonde rapidamente per colpire l’intero arto); edema massivo: teso e fermo, si sviluppa rapidamente; cianosi (decolorazione violacea): tipicamente inizia distalmente per poi diffondersi fino a coinvolgere l’intero arto; è causata dall’emoglobina deossigenata nelle vene stagnanti; assenza di polso arterioso (il polso femorale manca in circa il 9% dei pazienti); ipotensione arteriosa da shock ipovolemico; macchie della pelle o bolle da edema intenso; la condizione può progredire verso la gangrena venosa e la sindrome compartimentale; è associata ad alti tassi di amputazione e morte;
- phlegmasia alba dolens: è caratterizzata da un esteso gonfiore dell’intera gamba senza ischemia tissutale, perché un certo drenaggio venoso attraverso i vasi collaterali superficiali è conservato; precede la flemma cerulea dolens nel 50%-60% dei casi;
- embolia paradossale che porta all’ictus embolico criptogenetico;
- trombosi della vena ovarica post-partum che causa grave idronefrosi in caso di rapporto.
Prognosi
- Secondo uno studio danese su 74.157 pazienti di età media 66 anni, la mortalità dopo la diagnosi di TVP risulta: a 30 anni 84%; a 30 giorni 3%; tra i 31 e 364 giorni 13%; 1 -10 anni 42%; 11-30 anni: 69%.
- Su uno studio americano invece, di 1.142 pazienti con TVP isolato, la mortalità per tutte le cause è del 5,4% a 30 giorni, 20,3% a 1 anno e 29,6% a 3 anni.
- Su 482 pazienti in Norvegia alla prima diagnosi di TVP, la mortalità sembra essere del 4,6% a 30 giorni e del 21% a 1 anno.
- Infine, secondo uno studio del 2007, una PE fatale viene riportata in un massimo di 1 paziente ogni 200 dopo l’interruzione della terapia anticoagulante. TVP prossimale e distale mostrano lo stesso indice di mortalità.
Immagine 04
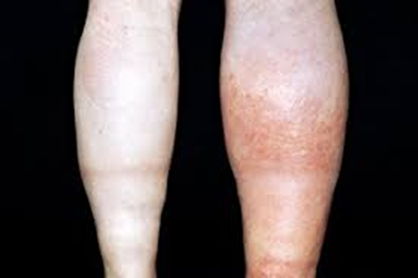
Asimmetria dell’area posteriore della gamba.