Dettagli
- Eziologia
- MODALITÀ DI INFEZIONE E DIFFUSIONE
- IMMUNOPATOGENESI
- ISTOPATOLOGIA
- CLINICA E FORME ANATOMO-CLINICHE
- RADIOLOGIA
- DIAGNOSI
- TERAPIA
Tubercolosi
- La Tubercolosi (TB) è una malattia infettiva contagiosa causata dal Mycobacterium tuberculosis (MT), un batterio che colpisce più frequentemente i polmoni sebbene possa interessare tutti gli organi, in particolare i reni, le ossa, le meningi e i genitali.
- È una condizione patologica che può assumere espressioni anatomo-cliniche diverse in relazione all’entità della carica infettante, al grado di virulenza del batterio e allo stato immunitario del soggetto infettato.
- La TB è una malattia con alta prevalenza e incidenza e secondo le stime dell’Organizzazione Mondiale della Sanità (WHO) nel 2016 ci sono stati nel mondo 10,4 milioni di casi incidenti di TB, di cui il 45% nel Sud-est asiatico, il 25% in Africa, il 17% nel Pacifico occidentale, il 7% nel Mediterraneo orientale, il 3% nelle Americhe e il 3% nell’Europa. Più della metà dei casi è concentrata in soli 5 Paesi: India, Indonesia, Cina, Filippine e Pakistan. Il tasso di incidenza globale è risultato pari a 140 casi per 100.000 abitanti, con un’ampia variabilità da un minimo di 27 casi nella Regione americana di sorveglianza WHO a un massimo di 254 casi in quella africana. Nonostante i tassi di incidenza globale si stiano riducendo negli ultimi anni, tale riduzione risulta comunque lontana dall’obiettivo del 4-5% fissato dal WHO per il 2020. Ancora oggi la TB è fra le prime dieci cause di morte nel mondo.
- In Europa nel 2016, sono stati stimati 290.000 nuovi casi di TB equivalenti a un tasso di 32 casi per 100.000.
- Nonostante il numero dei casi notificati nella Regione Europea sia in costante diminuzione, specifici sottogruppi di popolazione quali migranti, senza dimora, tossicodipendenti e detenuti presentano un rischio più elevato di contrarre l’infezione. Per quanto riguarda l’Italia, nel 2016 risulta un tasso stimato di incidenza di 6,6 casi per 100.000 (totale 4.032 casi notificati), in calo rispetto agli ultimi dieci anni; questo valore permette di classificare l’Italia tra i paesi a bassa endemia; il tasso grezzo di mortalità è diminuito da 22,5 per 100.000 nel 1995 a 0,7 per 100.000 nel 2006.
- Altri fattori di rischio per la TB sono rappresentati dalla più lunga sopravvivenza dei pazienti neoplastici e dei trapiantati, dal più ampio utilizzo di farmaci immunosoppressori e dal diffondersi dell’AIDS, tutte condizioni che, attraverso la compromissione delle difese immunitarie cellulo-mediate, aumentano la probabilità di contrarre la malattia tubercolare o le micobatteriosi causate da micobatteri non tubercolari.
Eziologia
- L’agente patogeno della TB umana è generalmente il Mycobacterium tubérculosis, indicato anche come bacillo di Koch (BK) dal nome di Robert Koch, il medico che lo identificò nel 1882 e che per tale scoperta fu insignito nel 1905 del premio Nobel per la Medicina.
- Appartiene alla famiglia delle Mycobacteriaceae e al genere Mycobacterium che comprende microrganismi a lenta crescita molto diffusi nel mondo; alcuni non sono patogeni per l’uomo ma altri, quali il Mycobacterium tuberculosis e il Mycobacterium leprae (bacillo di Hansen), sono responsabili di patologie con alta morbilità e mortalità. Sebbene i micobatteri possano provocare la patologia in diversi organi, due gruppi sono responsabili di infezioni polmonari: il gruppo del M. tuberculosis complex e il gruppo dei Micobatteri Non Tubercolari (MNT). Il primo gruppo include le specie clinicamente più rilevanti: il M. tuberculosis, il M. bovis (responsabile della Tubercolosi bovina e di alcune rare forme di Tubercolosi intestinale nell’uomo), il M. africanum (diffuso in Africa), il M. canettii (di raro riscontro) e il M. microti (ritrovato solo in soggetti immunocompromessi) (Tabella 01).
- I micobatteri sono patogeni intracellulari che, rispetto ad altri batteri hanno una parete cellulare con alto contenuto lipidico che conferisce loro alcune particolari caratteristiche: acido-alcool resistenza, lento tempo di moltiplicazione e resistenza ai comuni antibiotici.
- Sono bacilli pleomorfi, leggermente ricurvi, aciliati, asporigeni, aerobi obbligati, con debole positività alla colorazione di Gram. Caratteristica tintoriale del bacillo di Koch è l’acido-alcool resistenza (BAAR- bacilli alcool-acido resistenti) ovvero, una volta colorati con fucsina basica, mantengono una colorazione rossa anche se sottoposti a decolorazione con alcool etilico o acido cloridrico mentre gli altri batteri assumono il colore di contrasto (blu di metilene). Su quest’ultima proprietà si basa la colorazione di Ziehl-Neelsen (Immagine 01).
- Questa caratteristica tintoriale non è esclusiva del MT ma si ritrova in tutti i membri della famiglia dei micobatteri e in pochi altri microrganismi (Nocardia, Rhodococcus e Corynebacterium).
- La crescita del micobatterio è notevolmente lenta per cui su terreni solidi cresce formando colonie di colore giallastro nell’arco di tempo di 4-6 settimane mentre più rapida è la crescita su terreni liquidi. Inoltre i micobatteri tubercolari sono labili verso la luce e i raggi ultravioletti per cui sopravvivono poco in ambienti assolati e ben illuminati, mentre sono abbastanza resistenti ai comuni disinfettanti.
- La specie del micobatterio può essere identificata attraverso esami che utilizzano tecniche biomolecolari (sonde DNA-PCR).
Tabella 01

Tabella 01. Micobatteri di interesse clinico.
Immagine 01
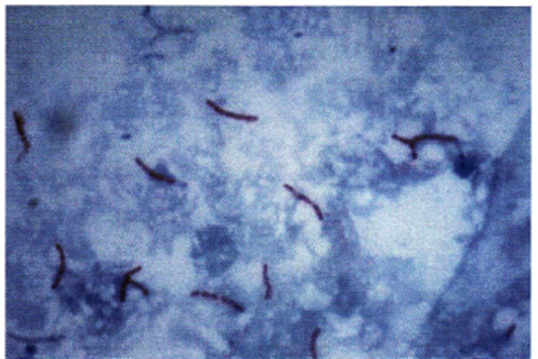
Immagine 01. Micobatteri.
MODALITÀ DI INFEZIONE E DIFFUSIONE
- La via di penetrazione abituale del bacillo tubercolare è la via aerea per contagio interumano. L’infezione viene acquisita attraverso l’inalazione di particelle di secrezioni biologiche (droplet nuclei) provenienti dalle vie aeree di soggetti con malattia tubercolare bacillifera ed emesse con la tosse, con gli starnuti o anche con il semplice parlare. Le particelle liberate, del diametro di circa 5 micron, contenenti i micobatteri, possono rimanere sospese nell’aria per alcune ore. Il rischio di infezione è correlato al grado di contagiosità dell’individuo affetto, alla forma ed estensione della malattia, alla capacità delle difese immunologiche del soggetto esposto, alla frequenza e durata dei contatti fra persona malata e persona sana e all’eventuale coabitazione in ambienti con scarsa igiene, ridotta ventilazione e con alta concentrazione di persone (prigioni, campi profughi, scuole, dormitori pubblici). L’aria che ristagna negli ambienti chiusi è contagiosa anche in assenza dell’ammalato.
- Si definisce contagioso un soggetto affetto da TB polmonare o delle vie aeree (laringea, bronchiale) che tossisca e che presenti BAAR all’esame microscopico dell’escreato.
- L’espettorato contenente materiale bacillifero emesso con i colpi di tosse rappresenta quindi la fonte principale di infezione in quanto diffonde i bacilli nell’aria e nell’ambiente circostante. Tale evenienza è più frequente nelle forme anatomo-cliniche cosiddette aperte, costituite dalle caverne tubercolari che, comunicando con l’esterno, rappresentano una pericolosa fonte di contagio e di trasmissione della malattia. Le forme chiuse invece, pur contenendo micobatteri nella lesione, non hanno comunicazione con l’esterno e quindi non risultano contagianti.
- I micobatteri inalati, una volta giunti in sede alveolare, determinano una flogosi inizialmente priva di caratteri di specificità che avrà la tendenza ad autolimitarsi in attesa che si completi la risposta dell’immunità cellulo-mediata e la formazione del granuloma. Questa è l’evenienza più frequente, ma in una piccola percentuale di casi, in relazione a un inefficace controllo da parte del sistema immunitario o per condizioni di immunodepressione o per un’eccessiva estensione ed evoluzione del focolaio iniziale, i bacilli possono diffondersi nell’organismo, superare il filtro linfatico delle stazioni linfonodali regionali e disperdersi per via linfoematogena in altre aree polmonari. La conseguente successiva localizzazione può essere circoscritta agli apici o diffusa in altri organi (foci extrapolmonari). Oltre alla via aerea esistono altre vie di contagio più rare come quella enterogena (per ingestione di latte proveniente da bovini affetti da Tubercolosi bovina, in passato modalità relativamente frequente) e cutanea, attraverso soluzioni di continuo della cute, evenienza possibile soprattutto per il personale sanitario di laboratori medici o di reparti di anatomia patologica o per alcune attività professionali (macellazione).
- Ulteriori modalità di diffusione sono rappresentate dalla p;opagazione per continuità o contiguità come avviene per estensione di lesioni nell’ambito dello stesso polmone o dal polmone alla contigua pleura; altra via di propagazione è costituita dalla via canalicolare nell’evenienza che i micobatteri diffondano in altri settori da una lesione cavitaria attraverso le vie naturali di drenaggio (bronchi, ureteri).
IMMUNOPATOGENESI
- Tutti i soggetti sono naturalmente recettivi alla TB non essendo dotati nei suoi confronti di un’immunità specifica. Quando l’individuo viene a contatto per la prima volta con i bacilli tubercolari gli eventi immunopatologici sono determinati da diversi fattori: dalla capacità dei bacilli di sopravvivere e di moltiplicarsi all’interno del macrofago (in relazione all’entità della carica e alla virulenza del patogeno) e dall’efficacia della risposta immunitaria dell’ospite nel contrastare l’invasione batterica.
- La prima linea di difesa verso l’invasione dei MT è costituita prevalentemente dal reclutamento dei macrofagi alveolari che cercano di aggredire e distruggere la maggior parte dei bacilli tubercolari penetrati per via inalatoria nel distretto alveolare. Questa è una risposta precoce aspecifica in quanto il potere battericida dei macrofagi alveolari prescinde da una precedente esposizione al micobatterio. Se il processo della fagocitosi è efficace e la carica infettante limitata, i micobatteri vengono distrutti, non si sviluppa alcuna lesione né si produce memoria immunologica.
- Tuttavia, in funzione della capacità microbicida intrinseca del macrofago condizionata dall’eventuale presenza di comorbilità, in grado di indebolire la competenza immunologica dell’individuo esposto, e in relazione all’entità della carica infettante e al suo grado di virulenza (capacità del batterio di resistere al killing intracellulare), una certa quota di microrganismi resiste al processo di fagocitosi e replicandosi determina la distruzione dei macrofagi. In seguito a questo evento si ha la liberazione di fattori chemiotattici i quali richiamano cellule infiammatorie a livello dei polmoni tra cui i monociti circolanti, che a loro volta si differenziano in macrofagi, e i T linfociti deputati ad amplificare le difese immunitarie e a rilasciare una serie di mediatori solubili quali l’IFN-y e il TNF-α, oltre a diverse interleuchine. L’IFN-y è un fattore fondamentale nel potenziare la fagocitosi e il killing da parte dei macrofagi attivati e nel favorire la differenziazione dei macrofagi in istiociti epitelioidi i quali concorrono a circoscrivere la lesione infiammatoria mediante la formazione dei granulomi tubercolari che hanno la funzione di limitare l’ulteriore moltiplicazione e la diffusione batterica. Si passa quindi da un’iniziale alveolite essudativa a una flogosi tessutale di tipo specifico man mano che si sviluppa l’immunità cellulo-mediata.
- Gli eventi biomorfologici che si realizzano con l’infezione primaria non danno manifestazioni cliniche nella maggior parte dei casi, ma lasciano nell’organismo una condizione di immunità permanente di tipo cellula-mediata determinata appunto dall’attivazione dei linfociti T sensibilizzati. Tale immunità acquisita è antigene specifica, si realizza nell’arco di 2-8 settimane e permette all’organismo di dotarsi di memoria immunologica attestata dal viraggio della cutireazione, ovvero dalla formazione della papula che si forma dopo 48 ore in seguito alla stimolazione antigenica provocata dalla iniezione intradermica di tubercolina (test tubercolinico di Mantoux-TST).
- Lo sviluppo dell’immunità specifica e l’accumulo dei macrofagi attivati e dei linfociti porta alla formazione di un granuloma nel sito della lesione primaria. I granulomi, che rappresentano l’espressione più matura della risposta difensiva acquisita nei confronti del MT, subiscono un processo centrale di necrosi che viene circoscritto da un vallo difensivo costituito da vari strati di cellule giganti multinucleate e di istiociti epitelioidi, e da cellule mononucleate (linfociti e monociti di derivazione ematica) e fibroblasti con la finalità di arginare l’ulteriore diffusione della malattia e di impedire la moltiplicazione dei micobatteri. La reazione necrotizzante al centro del granuloma, sebbene abbia lo svantaggio di distruggere tessuto parenchimale (necrosi caseosa), ha lo scopo di arrestare lo sviluppo della flora batterica, anche per la sfavorevole condizione di anaerobiosi presente all’interno del granuloma, che rimane confinata in uno stato di quiescenza, ma ancora vitale, a costituire focolai di possibile riattivazione (Infezione Tubercolare Latente, ITL).
- Per la maggior parte degli individui immunocompetenti la, proliferazione dei micobatteri si arresta una volta che l’azione dell’immunità cellulo-mediata si sia completata.
- Senza trattamento, il 5% delle persone con infezione primaria svilupperà la malattia nei primi 2 anni dall’infezione, e un altro 5% la contrarrà nell’arco della vita (Immagine 02).
- Dopo l’infezione primaria, il periodo d’incubazione della TB varia da poche settimane a una vita intera.
- Il focolaio primario, espressione della reazione flogistica polmonare alla prima infezione, ha la tendenza ad autolimitarsi per cui passa solitamente inosservato dal punto di vista clinico. Infatti si tratta di piccoli focolai infiltrativi che si circoscrivono e guariscono o possono esitare in una modesta cicatrice non sempre visibile al radiogramma standard del torace; pertanto l’unico indizio dell’avvenuta infezione è fornito dalla positività cutanea al test tubercolinico. Però in una piccola quota di pazienti, in seguito a modificazioni biomorfologiche del focolaio primario, l’infezione primaria può evolvere realizzando forme di TB primaria progressiva o morbigena. Questa eventualità è più comune nei bambini al di sotto dei 5 anni di età e negli adulti con malattie che compromettono il sistema immunitario (diabete, AIDS, insufficienza renale, neoplasie, malnutrizione, terapie immunosoppressive) ed è causata dall’incapacità dell’individuo a contenere la moltiplicazione dei bacilli che pertanto sfuggono al controllo immunitario e si diffondono in altre sedi. Nella maggior parte dei casi la via di diffusione è linfatica attraverso i vasi linfatici interstiziali fino ai linfonodi ilo-mediastinici, o ematica che può realizzare una forma di miliare acuta polmonare o causare in sedi extrapolmonari la formazione di potenziali foci per successive riattivazioni della malattia (Immagine 03).
- In sintesi, la prima volta che il bacillo tubercolare entra in un organismo non immunizzato si verifica la condizione denominata “prima infezione tubercolare”. Qualunque sia la via di penetrazione del bacillo tubercolare nell’organismo umano e qualunque sia l’organo bersaglio, si verificano due eventi sostanziali:
- il primo evento è di tipo anatomo-patologico e consiste nella formazione del complesso primario nella sede della prima infezione, costituito da tre elementi: il focolaio flogistico polmonare, la linfoadenopatia satellite e la linfangite interposta (complesso di Ranke). Esso passa solitamente inosservato, infatti regredisce spontaneamente con eventuale formazione di reliquati fibrocalcifici in cui possono permanere bacilli tubercolari quiescenti indicati come dormienti o murati vivi, potenziale fonte di una successiva ripresa della malattia in seguito a una compromissione delle difese immunitarie;
- il secondo evento è invece di tipo biologico e consiste nello sviluppo di una permanente immunità di tipo cellulare dimostrabile con la positività della intradermoreazione alla tubercolina (formazione di una papula dopo 48 ore dalla iniezione intradermica della tubercolina) che attesta l’avvenuto contatto con il MT.
- La risposta immunitaria acquisita, come quella naturale, ha una grande variabilità individuale che, associata alla carica e virulenza dell’agente infettante e alle sue modalità di diffusione, rende ragione dell’ampia varietà dei quadri clinico-radiologici della malattia tubercolare. Infatti alcuni soggetti circoscrivono efficacemente il bacillo nella sede dell’infezione, ma, se questo non avviene, l’infezione si diffonde nell’organismo. In altri casi può realizzarsi una risposta infiammatoria anomala, eccessiva nei confronti del bacillo di Koch, con conseguente danno a carico dei tessuti infetti. Tutti questi eventi sono determinanti per la sopravvivenza o meno del patogeno e per la sua moltiplicazione all’interno dei macrofagi dove può persistere per anni. Questi dinamici eventi biologici rivestono un ruolo fondamentale nel comprendere la distinzione tra l’infezione che indica la sola presenza del bacillo nell’ospite e la malattia che comporta invece la comparsa di manifestazioni cliniche e di alterazioni anatomopatologiche di tipo evolutivo indotte dall’agente patogeno.
Immagine 02
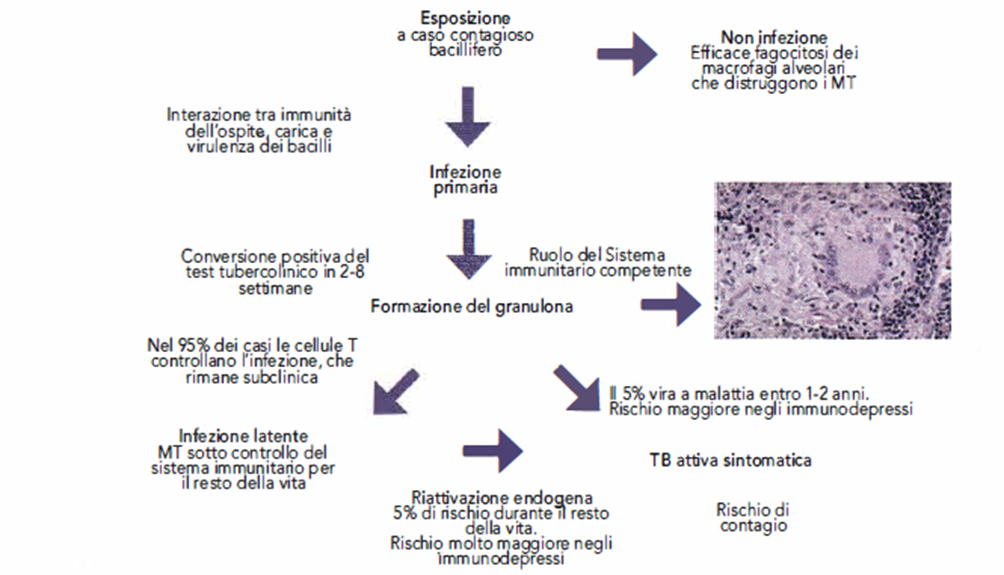
Immagine 02. lmmunopatogenesi.
Immagine 03
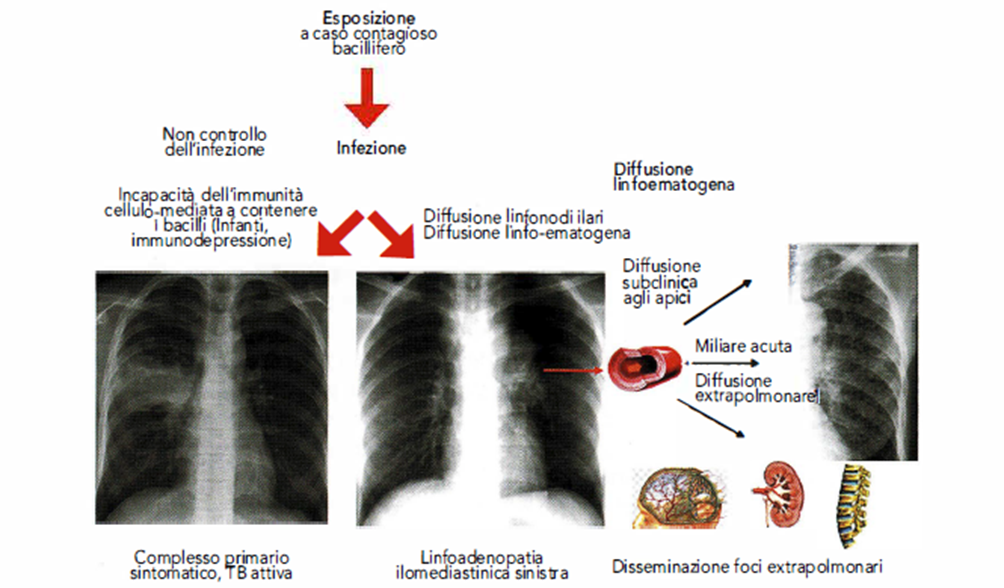
Immagine 03. Diffusione dell’infezione tubercolare.
ISTOPATOLOGIA
- La TB è una patologia granulomatosa la cui lesione fondamentale viene denominata tubercolo: si tratta di un piccolo nodulo che all’inizio è al di sotto della visibilità macroscopica e successivamente si ingrandisce fino alle dimensioni di un grano di miglio; aggregati di tubercoli possono formare lesioni nodulari.
- Il tubercolo è formato da granulomi microscopicamente costituiti da cellule epitelioidi, cellule giganti multinucleate (cellule di Langhans) circondate da fibroblasti e linfociti. Nella maggior parte dei casi la parte centrale della lesione va incontro a necrosi caseosa (granulomi caseificanti), caratteristica molto importante per la diagnosi differenziale con altre patologie granulomatose come la sarcoidosi in cui manca la necrosi. La necrosi caseosa può essere riscontrata anche in alcune infezioni da miceti quali l’istoplasmosi, la criptococcosi e la coccidioidomicosi.
- Il decorso della malattia nei suoi aspetti anatomo-clinici è condizionato dall’entità della risposta immunitaria e dalla configurazione dei processi istopatologici: la prevalenza della componente necrotica o della reazione fibroblastica riparativa realizza quadri differenti in funzione di un rapporto dinamico quanti-qualitativo tra reazione produttiva cellulare e componente essudativa. La risposta granulomatosa è espressione di una risposta immunitaria normale, incapace di eliminare il bacillo, ma in grado di confinarlo all’interno della lesione.
- L’evoluzione della reazione granulomatosa porta alla formazione di una cicatrice fibrotica con successiva precipitazione di sali di calcio, aspetti riscontrabili all’indagine radiografica come lesioni fibrocalcifiche parenchimali e/o linfonodali, interpretabili come esiti del complesso primario. In questa fase la malattia risulta inattiva, ma i bacilli possono sopravvivere per decenni in uno stato di quiescenza e rimanere vitali all’interno del processo fibrocalcifico.
- In caso di risposta immunitaria eccessiva con ampia componente essudativa (per caratteristiche intrinseche dell’ospite o per virulenza o per cariche infettanti notevoli) si ha la formazione di ampie aree necrotiche senza un vallo fibroblastico di demarcazione in grado di confinare il processo. L’apporto di enzimi litici nel focolaio di necrosi caseosa comporta la sua colliquazione che, drenata per via canalicolare attraverso un bronco di drenaggio, porta alla formazione della caverna tubercolare. In questi casi si può determinare una disseminazione di micobatteri con conseguente infezione delle zone circostanti. Quando il materiale caseoso viene completamente circoscritto da connettivo fibroso si forma una lesione unica nodulare rotondeggiante denominata tubercoloma.
- La sostanza caseosa è di aspetto biancastro e piuttosto friabile, simile al formaggio (caseum).
- Nella formazione della caverna tubercolare, quando il processo escavativo è tumultuoso e rapido, il lume cavitario può essere attraversato da numerosi grossi tralci e sepimenti contenenti strutture bronchiali e vasi trombizzati, talora con la formazione di aneurismi (aneurismi di Rasmussen) responsabili di fenomeni emoftoici anche massivi.
CLINICA E FORME ANATOMO-CLINICHE
- La presentazione clinica della malattia è eterogenea in quanto può variare da condizioni paucisintomatiche a quadri di malattia grave con interessamento multiorganico; ciò dipende dall’equilibrio che si determina tra l’aggressività dei microrganismi e i poteri di difesa dell’ospite con conseguente variabilità del dinamismo evolutivo delle lesioni. Nella storia clinica della TB si distinguono due forme principali: la TB primaria e la TB secondaria o post-primaria o da riattivazione. La prima si manifesta come conseguenza della prima infezione tubercolare, la seconda si verifica, nella maggior parte dei casi, per una riattivazione endogena di un’infezione tubercolare latente oppure per una nuova infezione proveniente dall’esterno (reinfezione esogena). Un periodo di latenza di durata variabile e imprevedibile separa la TB primaria dalla postprimaria.
- L’infezione primaria nella maggior parte dei soggetti è asintomatica e la diagnosi viene formulata con la positività della cutireazione tubercolinica. Anche l’esame radiologico standard del torace può far ipotizzare l’avvenuta infezione primaria qualora siano presenti immagini radiologiche compatibili con gli esiti di un complesso primario. A volte compaiono sintomi modesti e aspecifici caratterizzati da tosse secca e da febbricola che non richiedono approfondimenti diagnostici in quanto nella maggior parte dei casi vengono attribuiti a forme simil-influenzali. Qualora la TB primaria abbia un esordio e un’evoluzione clinicamente rilevanti per la presenza di manifestazioni cliniche di tipo sistemico quali febbricola persistente, calo ponderale, sudorazioni notturne, anemia, o per la comparsa di un eritema nodoso agli arti inferiori o di emottisi (in corso di lesioni cavitarie o di TB endobronchiale) si è indotti a eseguire accertamenti clinici e radiologici. L’eritema nodoso, provocato dalla deposizione di complessi immuni circolanti, non è una manifestazione peculiare della TB potendosi riscontrare anche in altre patologie quali la sarcoidosi, le infezioni da streptococchi e le allergie ai farmaci.
- L’esame radiografico può documentare in queste forme sintomatiche la presenza di uno o più elementi del complesso primario, ovvero un’opacità parenchimale più o meno periferica (iniziale focolaio essudativo), un ingrandimento dell’ombra ilare omolaterale (linfadenopatia satellite) e, più raramente, le strie linfangitiche interposte. L’adenomegalia entra in diagnostica differenziale con altre condizioni patologiche quali il morbo di Hodgkin, la neoplasia polmonare e la sarcoidosi. La linfoadenopatia, se molto grande, può dare come complicanza la compressione di un bronco adiacente con conseguente ipoventilazione o atelettasia del parenchima a valle. Tale evenienza, più frequente nei bambini, indicata anche come sindrome adenobronchiale, si verifica prevalentemente a carico del lobo medio per la conformazione sottile e allungata del suo bronco tributario (sindrome del lobo medio).
- In alcuni soggetti è possibile l’insorgenza di un focolaio di tipo polmonitico con sintomatologia più grave: febbre elevata, tosse produttiva, astenia e dimagrimento. I segni clinici sono gli stessi di una polmonite aspecifica. Questi quadri possono evolvere verso la necrosi di aree anche estese con escavazione delle stesse (quadri definiti con il termine di tisi primaria). La cavitazione facilita la diffusione dei micobatteri per via endobronchiale.
- L’infezione tubercolare può diffondersi anche per via ematica o linfatica, in modo circoscritto al polmone dove tende a interessare prevalentemente le zone apicali, oppure in modo disseminato per via ematogena realizzando le miliari acute generalizzate. Questi sono processi caratterizzati dall’interessamento diffuso del polmone e sovente anche di altri organi il cui decorso clinico può essere molto grave per la comparsa di Insufficienza Respiratoria o per l’interessamento del sistema nervoso centrale (TB miliare polmonare, meningite tubercolare) (Immagine 03).
- L’evoluzione più frequente del complesso primario non morbigeno è la graduale regressione prima del focolaio parenchimale e poi dell’adenite nell’arco di alcuni mesi; la risoluzione si completa con la riparazione fibrosclerotica ed eventualmente calcifica dei due focolai.
- La pleurite è una comune manifestazione della TB causata dalla diffusione alla sierosa dei micobatteri dalla rottura nello spazio pleurico di foci caseosi parenchimali subpleurici. L’analisi batteriologica del liquido di tipo essudatizio, a prevalenza linfocitaria, raramente risulta positiva ma sulla superficie pleurica alle indagini diagnostiche invasive, agobiopsia pleurica transtoracica e toracoscopia, si riscontrano i tipici granulomi (Immagine 04). I campioni bioptici vanno sempre sottoposti non solo alle indagini istologiche ma anche all’esame colturale. L’empiema tubercolare rappresenta un’infezione cronica attiva che può lentamente esitare in un versamento concamerato determinando un grave danno anatomico per l’ipoespansibilità e/o incarceramento del polmone sottostante con possibile evoluzione in fibrotorace (Immagine 05). Nell’ambito delle sierositi tubercolari la pericardite essudativa e/o costrittiva rappresenta la complicanza cardiaca più comune della malattia. La TB primaria era in passato prevalentemente appannaggio esclusivo dell’eta infantile in quanto la malattia era endemica, oggi invece è possibile riscontrarla anche in età giovanile e adulta. Il complesso primario si può osservare anche in sede extrapolmonare come avviene a livello delle tonsille quando la porta di ingresso del bacillo è l’orofaringe. Sul piano clinico si presenta con adenopatia satellite sottomandibolare o laterocervicale che può fistolizzarsi alla cute (scrofola).
- La TB postprimaria si verifica in soggetti che hanno già sviluppato una sensibilizzazione del sistema immunitario verso il MT e origina nella maggior parte dei casi da una riattivazione endogena dei bacilli in seguito a un indebolimento delle difese immunitarie. Questa modalità è più frequente nelle nazioni a bassa incidenza tubercolare mentre nelle nazioni a elevata incidenza è più frequente la reinfezione esogena per contagio da soggetti bacilliferi. Fra i vari fattori di rischio in grado di compromettere le difese dell’ospite e contribuire all’insorgenza della TB da reinfezione endogena ci sono le malattie ematologiche e le neoplasie solide, l’insufficienza renale cronica, il diabete mellito, la silicosi, l’alcolismo, l’utilizzo di terapie immuosoppressive e qualsiasi altra condizione patologica debilitante (Tabella 02).
- Nella TB postprimaria si ripetono gli eventi patologici già descritti nella immunopatogenesi della forma primaria, ma in corso di riattivazione i processi essudativo-necrotici sono più tumultuosi con rapida progressione numerica e dimensionale delle lesioni e conseguente formazione di lesioni cavitarie che rappresentano la maggiore fonte di contagio. Se invece prevalgono i fattori difensivi si avvia un processo di tipo riparativo fibrosante cronico che può portare più facilmente a forme di TB cronica con danneggiamento strutturale rappresentato da aree di enfisema paracicatriziale e di bronchiectasie da trazione. Le manifestazioni cliniche non sono specifiche e ripetono quelle già riportate nella Tubercolosi primaria quali febbre, astenia, dimagrimento. La tosse di tipo produttivo è il sintomo più frequente, complicata da fenomeni emoftoici causati dalla presenza di ulcerazioni e/o cavìtazioni. Le caverne possono essere colonizzate da ife fungine che formano conglomerati intracavitari i quali possono provocare emottisi fulminanti con pericolo di vita per il paziente per asfissia secondaria all’inondazione di sangue delle vie aeree (micetoma o aspergilloma intracavitario) (Immagine 06).
- La disseminazione per via ematica può portare a forme di TB miliare con estensione ai polmoni e/o diffusione in altri organi, soprattutto a carico dell’apparato genitourinario, dei surreni e delle vertebre toraciche inferiori (morbo di Pott). Si realizzano in tal modo quadri di TB extrapolmonare che hanno autonomia clinica ben definita. Il rischio di malattia extrapolmonare è più elevato nei pazienti con AIDS.
- L’esame obiettivo del torace non fornisce informazioni utili e i reperti sono aspecifici e analoghi a quelli riscontrabili in tutti i processi infiammatori parenchimali.
- Dal punto di vista nosografico sono state descritte diverse forme di TB postprimaria: la Tubercolosi apicale, l’Infiltrato sottoclaveare tisiogeno (è una lesione nodulare caseosa che, attraverso la fistolizzazione e lo svuotamento in un bronco, porta alla forma cavitaria), la TB cronica degli apici, le Lobiti e le Broncopolmoniti tisiogene e infine varie forme di TB miliare (acute, subacute, croniche, regionali o disseminate). In conclusione, a prescindere dai diversi inquadramenti nosografici proposti in passato dalle varie scuole tisiologiche, è necessario ricordare che gli aspetti anatomo-clinico-radiologici della Tubercolosi sono molteplici in relazione alle modalità di diffusione del germe, all’esistenza di pregressi esiti cicatriziali e al dinamismo dei processi di flogosi e di riparazione che si alternano nel tempo e che possono portare a un sovvertimento strutturale del parenchima polmonare per l’estensione degli esiti sclerocalcifici (fibrotorace).
Tabella 02

Tabella 02. Condizioni acquisite di immunodepressione associate al rischio di riattivazione della TB.
Immagine 04
Immagine 04. Toracoscopia. Micronodulazioni della pleura parietale alla toracoscopia.
Immagine 05
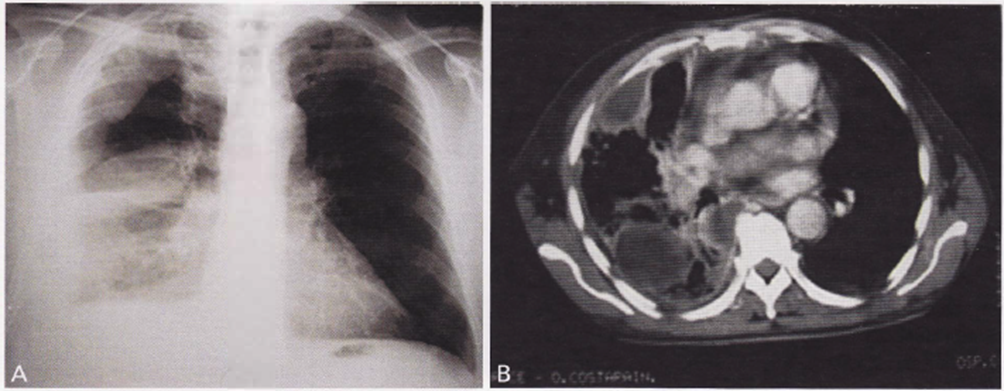
Immagine 05. Versamento pleurico. A) Versamento pleurico destro pluriconcamerato alla radiografia standard. B) Alla tomografia computerizzata con tecnica per la finestra mediastinica.
Immagine 06
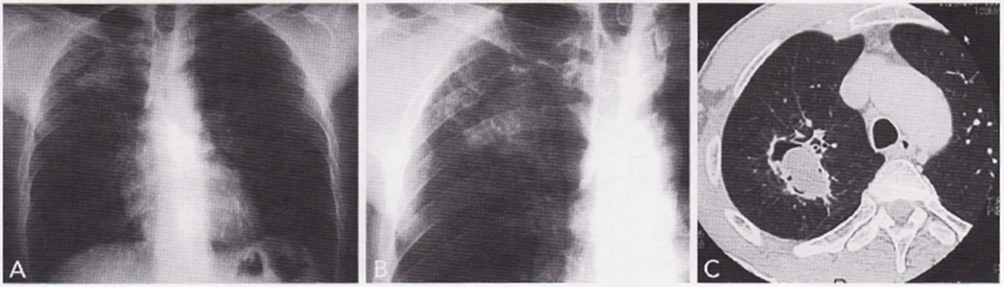
Immagine 06. Micetoma polmonare. A) Rx Torace con opacità lobo superiore destro. B) particolare con alone di ipertrasparenza nella porzione superiore dell’opacità. C) TC torace: strato a livello dell’apice polmonare destro. Micetoma intracavitario all’interno di una cavità, con orletto di aria responsabile dell’iperdiafania all’Rx.
RADIOLOGIA
- I quadri radiologici della TB, come già riferito, sono molteplici e riflettono la diversità delle forme anatomo-patologiche e, anche se orientativi, non sono mai specifici. Nella Tubercolosi primaria il più comune riscontro è la linfadenopatia ilare che può evidenziarsi precocemente, subito dopo la cuti-conversione, e comunque entro i due mesi dall’infezione. Il complesso primario, quando si manifesta nella sua completa espressione, si presenta come un addensamento alveolare, più o meno sfumato, di solito omogeneo, denso, di estensione limitata a un segmento (meno frequente è l’impegno multifocale), associato a linfadenopatia ilo-mediastinica satellite omolaterale (Immagine 07, 08). La risoluzione del focolaio parenchimale può lasciare come esito una piccola cicatrice, non sempre visibile al radiogramma standard del torace, mentre più evidenti possono essere i reliquati fibrocalcifici in sede linfonodale. Nel corso dell’evoluzione del processo primario il mancato controllo dei bacilli da parte del sistema immunitario può comportare una diffusione per via ematogena e realizzare il quadro clinico-radiologico della TB miliare diffusa (Immagine 09). In questo caso la radiografia del torace mostra la presenza di piccoli noduli diffusi bilateralmente, delle dimensioni di 1-2 mm, meglio evidenziabili alla tomografia computerizzata con tecnica ad alta risoluzione (High Resolution Computed Tomography, HRTC) che dimostra la loro distribuzione casuale, random, rispetto alla struttura dei lobuli polmonari secondari; questo è un aspetto rilevante per la diagnosi differenziale con altre condizioni patologiche caratterizzate da lesioni micronodulari diffuse (Immagine 10). In corso di TB si può manifestare un versamento pleurico che in alcuni casi può avere un decorso cronico con evoluzione in empiema o in una forma organizzata pluriconcamerata meglio evidenziabile con la TAC (Immagine 05).
- I pazienti con TB secondaria hanno sempre anomalie radiologiche anche in assenza di sintomi. La riattivazione tubercolare del periodo postprimario appare contrassegnata dall’interessamento dei segmenti apicali e posteriori dei lobi superiori, mono o bilaterale con aspetti di tipo fibronodulare associati a processi di escavazione (Immagine 11,12). L’andamento cronicizzante della Tubercolosi riattivata può realizzare un sovvertimento strutturale del parenchima con fenomeni retraenti di tipo riparativo cicatriziale, apparentemente inattivi sul piano biologico ma che invece possono rappresentare una fonte di disseminazione bacillare (Immagine 13,14). In tali casi l’esame radiologico non consente di esprimere un giudizio di certezza sull’attività del processo tubercolare che si deve basare sul monitoraggio radiologico delle lesioni con radiogrammi seriati nel tempo, su esami batteriologici sequenziali, ma è sempre la clinica a orientare la diagnosi definitiva . Uno dei più comuni segni radiologici di malattia tubercolare è la presenza di piccoli noduli con tendenza alla diffusione nel lobulo polmonare secondario. Tali immagini, evidenziabili solo all’HRTC, vanno sotto il nome di “tree in bud sign” e riflettono la diffusione endobronchiale della flogosi tubercolare, ma più in generale di un qualsiasi processo flogistico-infettivo per riempimento del lume dei bronchioli terminali tipo impatto mucoide (Immagine 13,15).
- Il tubercoloma è una forma di Tubercolosi postprimaria mono nodulare la cui denominazione deriva dal fatto che spesso può simulare una neoplasia. L’aspetto radiologico è quello di una formazione rotondeggiante più o meno voluminosa, da 0,5 a 4 cm, a contorni lisci e a contenuto radiopaco disomogeneo per la coesistenza di materiale caseoso, tessuto connettivo cicatriziale e calcificazioni. L’indagine PET-FDG può mostrare attività al metabolismo del glucosio che va interpretato come un falso positivo per malignità.
Immagine 07
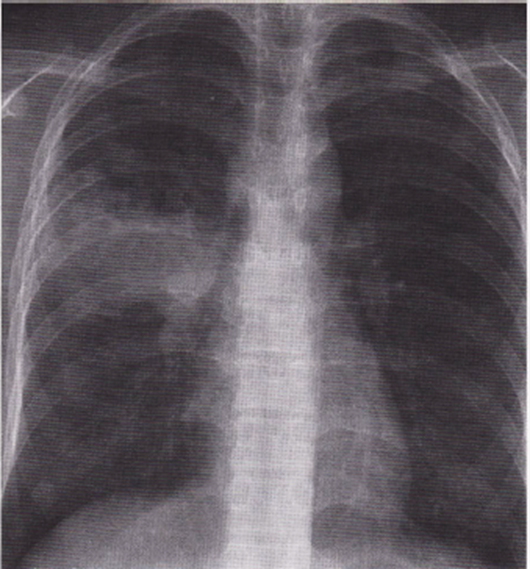
Immagine 07. TB primaria. TB primaria con addensamento parenchimale in campo medio destro e adenopatia satellite: complesso primario.
Immagine 08
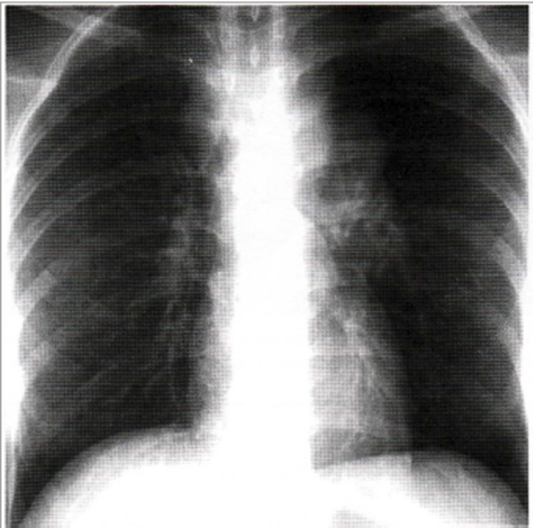
Immagine 08. Linfoadenopatia ilo-mediastinica. Linfoadenopatia ilo-mediastinica sinistra e paratracheale destra in un giovane con TB primaria.
Immagine 09
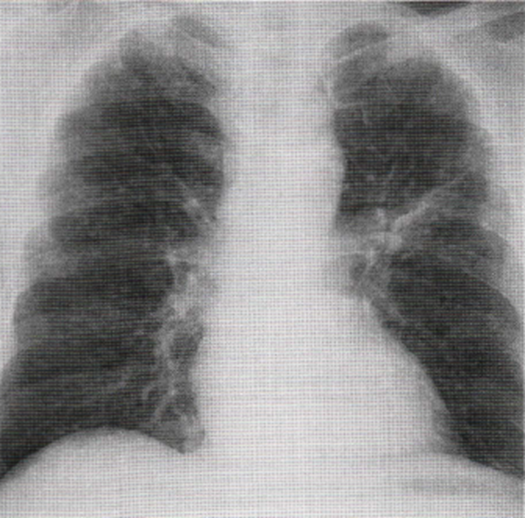
Immagine 09. Ingrandimento ilare.Ingrandimento ilare sinistro e aspetto radiografico di noduli diffusi bilateralmente di tipo miliarico.
Immagine 10
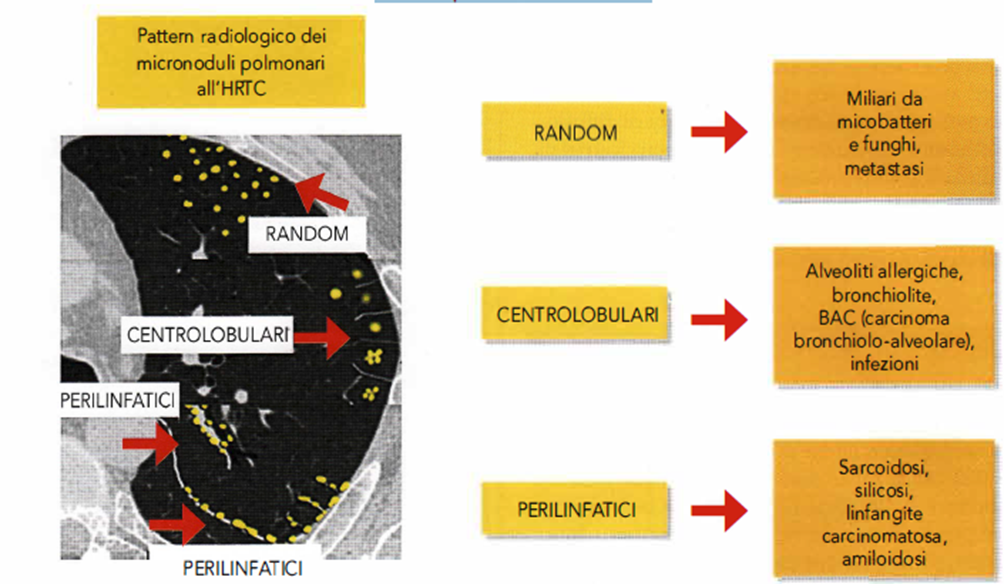
Immagine 10. Diagnostica differenziale dei micronoduli polmonari all’HRTC in base a una loro distribuzione rispetto al lobulo polmonare secondario.
Immagine 11
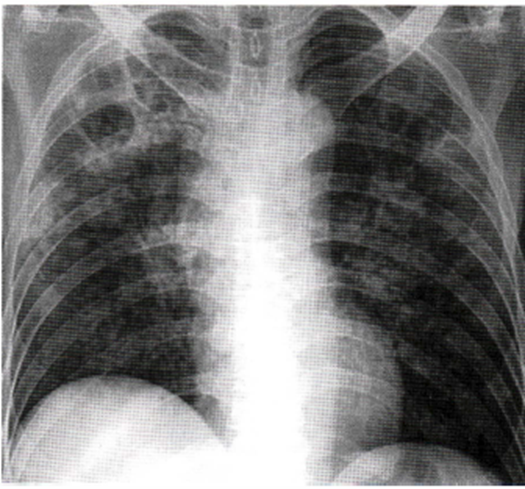
Immagine 11. TB postprimaria. TB postprimaria in uomo di 50 anni con consolidazione
disomogenea in campo superiore destro con immagine cavitaria. Presenza di noduli non ben definiti diffusi bilateralmente.
Immagine 12
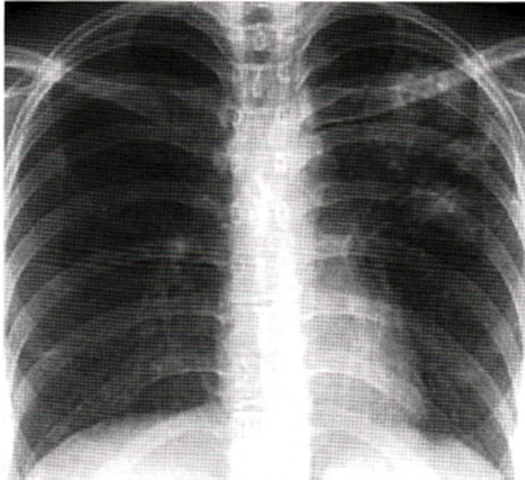
Immagine 12. TB postprimaria. TB postprimaria: immagini nodulari in campo superiore sinistro di cui una escavata.
Immagine 13
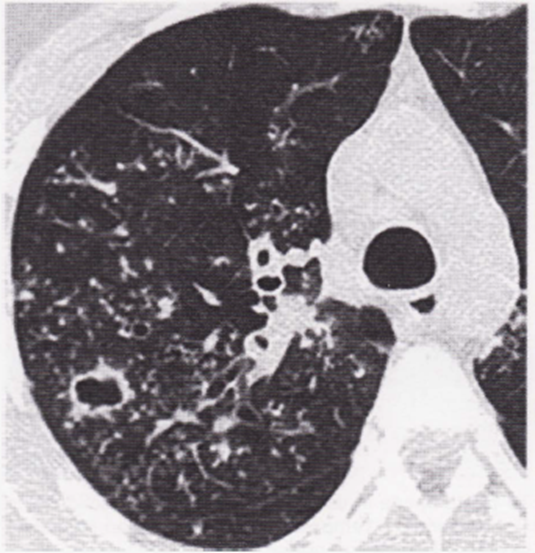
Immagine 13. TB postprimaria. TB postprimaria: quadro TC di processo escavato lobo superiore destro e imryiagini micronodulari riferibili all’aspetto “tree in bud”.
Immagine 14
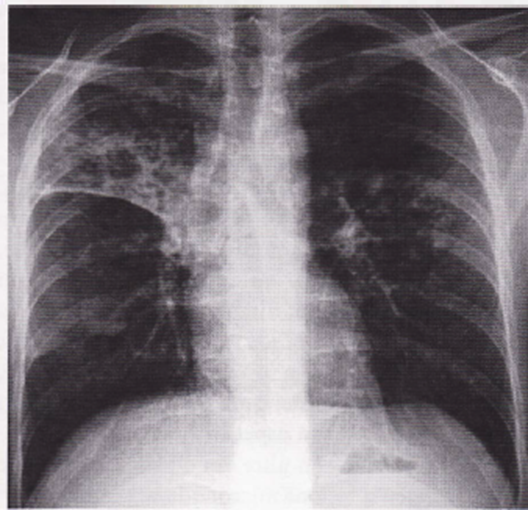
Immagine 14. TB postprimaria con caverna. TB postprimaria con caverna e immagini satelliti ad andamento retraente a livello del lobo polmonare superiore destro (lobite tisiogena). Altre immagini non ben definibili in campo polmonare inferiore destro e in campo medio a sinistra.
Immagine 15
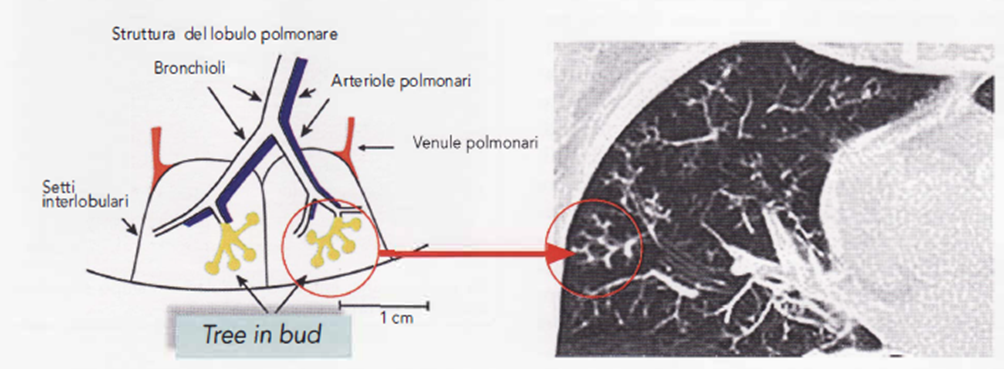
Immagine 15. Lobulo polmonare. A sinistra schema di un lobulo polmonare secondario con riprodotto l’aspetto del “tree in bud”. A destra particolare di uno strato TC con il quadro del “tree in bud”, come indicato dalla freccia e cerchietto.
DIAGNOSI
- La diagnosi eziologica della malattia richiede la ricerca e l’isolamento dei micobatteri nei campioni biologici (espettorato, liquido pleurico, lavaggio bronchiale, biopsie, urine, liquor ecc.), l’identificazione a livello di specie e la determinazione della sensibilità del ceppo isolato ai farmaci antitubercolari.
- La ricerca e l’isolamento vengono effettuati mediante l’esame microscopico e l’esame colturale. Il primo viene classicamente eseguito con la colorazione di Ziehl-Neelsen che sfrutta l’alcool-acido resistenza dei bacilli. La positività dei bacilli alcool-acido resistenti nel campione biologico ha una bassa sensibilità e non identifica il M. tuberculosis in quanto può essere riscontrata in altre infezioni come quelle causate dalla Nocardia o dai Micobatteri non tubercolari. Il gold-standard diagnostico è rappresentato dall’esame colturale, complemento imprescindibile dell’esame microscopico, in quanto permette l’identificazione della specie micobatterica, consente di testare la sensibilità ai farmaci e la genotipizzazione dei bacilli per individuare mutazioni specifiche associate con la farmaco-resistenza.
- L’esame microscopico e l’esame colturale possono essere effettuati su vari materiali biologici ma l’espettorato è quello più frequentemente analizzato per la facilità e la ripetibilità del campionamento (almeno tre campioni raccolti in giorni diversi). In caso di assenza o scarsità di escreato si ricorre alla metodica dell’espettorato indotto con l’inalazione di soluzione salina ipertonica al 3% per favorirne la produzione oppure è necessario utilizzare il liquido di lavaggio bronchiale prelevato con procedura broncofibroscopica. Inoltre, l’esame endoscopico consente la raccolta mirata del materiale biologico e fornisce elementi utili per la diagnosi differenziale con altre malattie che possono mimare la TB e permette il riconoscimento della TB endo- bronchiale che può risultare misconosciuta alle indagini radiologiche.
- Attualmente, per minimizzare i tempi di isolamento e di identificazione, l’esame colturale si effettua su terreni liquidi in incubatori automatici; il vantaggio consiste nella riduzione dei tempi di coltura, 7-21 giorni rispetto alle 3-8 settimane richieste dai terreni solidi, e nel miglioramento della sensibilità che varia tra 1’80% e il 93%.
- Alta resa diagnostica hanno i campioni bioptici se sottoposti all’esame colturale oltre che all’esame istologico che evidenzia il caratteristico granuloma necrotizzante; questo granuloma non è specifico della TB in quanto si può riscontrare anche nelle micosi, nelle actinomicosi e nelle reazioni da corpo estraneo.
- Se il paziente è già in chemioterapia antitubercolare occorre sospenderla per almeno 4-5 giorni prima di prelevare il materiale da esaminare per evitare che la crescita batterica sia ostacolata o ritardata dalla terapia in atto.
- L’identificazione di specie del bacillo viene effettuata dopo l’isolamento in coltura con i tradizionali test biochimici oppure, in tempi più rapidi, con i test molecolari.
- La necessità di una diagnostica rapida e altamente sensibile ha portato allo sviluppo delle tecniche biomolecolari con amplificazione genica per la ricerca del M. tuberculosis complex direttamente nei campioni biologici. L’amplificazione genica, attraverso la reazione polimerasica a catena (PCR), consente in poche ore la diagnosi laboratoristica e la tipizzazione e risulta positiva anche per campioni con bassa carica batterica.
- L’uso del test di amplificazione non deve prescindere dalla contemporanea esecuzione dei tradizionali test batterioscopici e colturali.
- La diagnostica di laboratorio si conclude con la valutazione della sensibilità del micobatterio isolato ai farmaci antitubercolari soprattutto quando si sospetta una TB farmaco resistente o quando un primo trattamento è fallito.
- Recentemente è stato approntato un esame di amplificazione degli acidi nucleici PCR real-time (Xpert MTBIRIF) per identificare il M. tuberculosis e contemporaneamente saggiare la sensibilità dei bacilli alla rifampicina.
TERAPIA
- La terapia farmacologica con più farmaci, a dosi piene e per lungo tempo, rappresenta il cardine del trattamento che è in grado di conseguire stabili e complete guarigioni nella quasi totalità dei casi, in particolare nei pazienti residenti in nazioni con sistemi sanitari più evoluti, e di determinare una rapida eradicazione batterica nei malati con espettorato positivo, riducendo così il periodo di contagiosità.
- La necessità di usare contemporaneamente più antibiotici, polichemioterapia, si basa sul raggiungimento dei seguenti obiettivi:
- evitare o ritardare i fenomeni della resistenza micobatterica;
- consentire l’eliminazione di tutti i micobatteri, sia extra che intracellulari, presenti nei focolai granulomatosi e nella sostanza caseosa, in virtù delle diverse proprietà farmacodinamiche e farmacocinetiche delle singole molecole impiegate.
- Tali obiettivi si raggiungono attraverso un impiego razionale dei farmaéi che si basa sui seguenti principi:
- associare farmaci per i quali non sono previsti fenomeni di resistenza crociata;
- impiegare comunque ogni farmaco a pieno dosaggio;
- evitare l’impiego contemporaneo di farmaci dotati di analoga tossicità di organo;
- utilizzare, in attesa dell’antibiogramma, almeno 2 farmaci per i quali si presume l’assenza di resistenza ai micobatteri.
- Il regime iniziale di trattamento standard prevede un ciclo breve di 6 mesi, con 4 farmaci nei primi due mesi, isoniazide (INH), rifampicina(RIF) , pirazinamide (PZA) ed etambutolo (ETB), e poi 2 farmaci, isoniazide e rifampicina nei successivi 4 mesi (Immagine 16).
- Il trattamento con 2 farmaci può essere protratto sino a 7 mesi nelle seguenti situazioni:
- pazienti con TB polmonare cavitaria causata da bacilli sensibili ai farmaci e pazienti con esame colturale positivo dopo i primi 2 mesi di trattamento;
- pazienti che nei primi due mesi di terapia non abbiano fatto la PZA;
- pazienti con HIV che non abbiano ricevuto la terapia antiretrovirale durante il trattamento della TB;
- pazienti trattati con schema terapeutico settimanale con INH e rifapentina e quelli che a completamento della fase intensiva dei primi due mesi abbiano un esame colturale positivo.
- La pirodossina (vitamina B6), 25-50 mg/day, viene prescritta ai pazienti che assumono INH e sono a rischio di neuropatia (donne gravide, persone con HIV, pazienti con diabete, alcolisti, insufficienza renale cronica e malnutrizione o età avanzata); invece per pazienti con neuropatia periferica il dosaggio di vitamina B6 è di lO0mg/die.
- Più complessa è la terapia della TB farmaco-resistente (TB-DR) che deve sempre essere impostata con il supporto dei test di sensibilità ai farmaci (DST). Infatti, a causa dei trattamenti condotti empiricamente o eseguiti con irregolarità per scarsa compliance del paziente, l’Organizzazione Mondiale della Sanità (WHO- World Health Organization) stima che ogni anno ci siano mezzo milione di nuovi casi di TB resistente alla Rifampicina’(RR-TB) e con doppia resistenza alla Rifampicina e all’Isoniazide (MDR-TB).
- La terapia della TB resistente ai farmaci deve attenersi a linee guida consolidate e aggiornate. Il Centro per il controllo e la prevenzione delle malattie (CDC di Atlanta-USA) e la WHO hanno aggiornato nel 2019 le LL.GG. per il trattamento della TB farmaco resistente. Il razionale del trattamento deve tenere conto di numerosi criteri sia per impostare la durata che per stabilire il numero e il tipo dei farmaci da utilizzare. Sono previsti trattamenti di diversa durata, quelli più brevi che possono variare dai 9 ai 12 mesi e trattamenti più lunghi per una durata di 18-20 mesi, con l’utilizzo di 4-5 farmaci per i primi sei mesi e 3-4 per il periodo successivo. Basilare per l’impostazione della terapia è la definizione del tipo di farmaco-resistenza che prevede le seguenti principali forme di resistenza secondo lo schema riportato:
- mono-resistenza alla Rifampicina (RR-TB) o mono-resistenza all’Isoniazide ma non alla Rifampicina. Per identificare rapidamente i MB resistenti alla Rifampicina è previsto l’uso del Xpert MTB/RIF assay;
- resistenza contemporanea alla Rifampicina e all’Isoniazide (Multidrug-resistant TB MDR-TB);
- polifarmaco-resistenza (PDR-TB) causata da microrganismi che presentano resistenza a più di un farmaco ma non all’Isoniazide e alla Rifampicina;
- farmaco-resistenza estesa (XDR-TB) caratterizzata da ceppi non solo MDR ma anche resistenti a un Fluorochinolone e a un farmaco iniettabile di seconda linea (Amikacina, Kanamicina, Capreomicina).
- I farmaci utilizzati nel trattamento della TB-DR sono riportati nella tabella 03.
- La multiresistenza influenza in maniera significativa la gestione e la prognosi. Il riscontro di una multiresistenza primaria nel soggetto immunocompetente è evento del tutto infrequente (1%) per cui la stragrande maggioranza dei casi di TB resistente è osservata nei soggetti immunocompromessi, nei soggetti con AIDS, ma soprattutto in pazienti già sottoposti a uno o più trattamenti. È consigliabile che la terapia sia condotta sotto la supervisione di Centri con esperienza nel trattamento della TB-DR allo scopo di gestire le intolleranze e la tossicità dei farmaci e per prevenire l’insorgenza di nuove resistenze.
- Molta attenzione va dedicata all’individuazione e alla gestione dei contatti per sottoporli al trattamento previsto dalle LL.GG nell’ipotesi che abbiano contratto l’infezione da micobatteri farmaco-resistenti.
Immagine 16
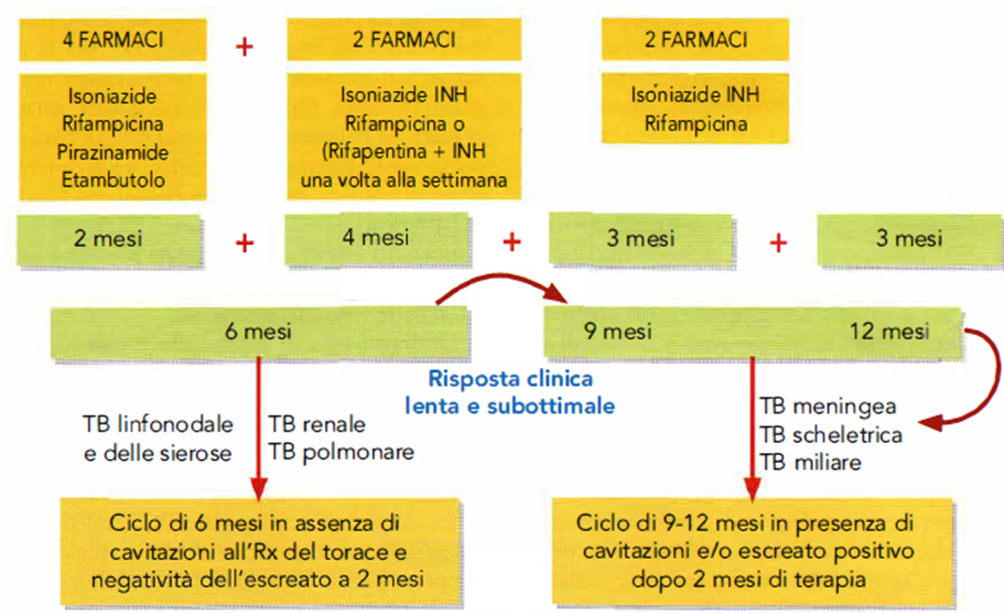
Immagine 16. Schemi terapeutici della tubercolosi.
Tabella 03

Tabella 03. Farmaci per il trattamento della TB multiresistente.
INFEZIONE TUBERCOLARE LATENTE
- L’Infezione Tubercolare Latente (ITL) è la condizione clinica di un soggetto che ha contratto l’infezione del Mycobacterium tuberculosis, prevalentemente per inalazione, ma che non presenta alcuna evidenza clinica, radiologica e microbiologica della malattia tubercolare e quindi non è contagiosa.
- Questa condizione rappresenta la sorgente di gran parte dei casi futuri di Tubercolosi (TB). Infatti, le persone con ITL, in assenza di trattamento, hanno un rischio più elevato nel tempo di sviluppare la malattia attiva.
- Si stima che la ITL interessi un quarto della popolazione mondiale e riguardi il 12% della popolazione italiana. Non sarà possibile eliminare la TB entro il 2050, obiettivo fissato dall’OMS, senza individuare i soggetti portatori dell’infezione. Pertanto, la diagnosi e il trattamento della ITL rappresentano una priorità dei programmi nazionali e mondiali di controllo della TB.
- L’Infezione Tubercolare Latente comporta una persistente risposta immunitaria alla stimolazione antigenica di pochi bacilli, dormientima vitali. Il termine “bacilli dormienti” definisce uno stato di metabolismo ridotto come è dimostrato da studi autoptici di soggetti deceduti per cause non correlate alla TB in cui sono stati ritrovati bacilli tubercolari vitali nei granulomi caseosi o necrotici del tessuto polmonare o linfonodale.
- La ricerca della ITL e la sorveglianza dei soggetti esposti vanno attuate nell’ambito di due categorie di soggetti a rischio elevato: la prima comprende soggetti che hanno un elevato rischio di esposizione al M. T. per i quali occorre attuare misure di prevenzione del contagio e verificare la risposta immunologica ai test; la seconda categoria comprende invece persone che già risultano infette e che bisogna trattare o sorvegliare affinché la ITL non progredisca in malattia attiva. Tali categorie sono elencate nella tabella 04.
- La progressione della ITL verso la malattia conclamata è un evento raro nelle persone senza fattori di rischio, ma rappresenta un evento probabile nelle persone appartenenti alle suddette categorie.
- Gli Operatori Sanitari appartengono alla prima categoria perché potenzialmente esposti a pazienti con malattia attiva contagiosa oppure a campioni biologici infetti, ma possono rientrare anche nella seconda categoria qualora, in occasione dei controlli sanitari periodici, sia diagnosticata l’infezione. Inoltre le persone anziane sono a maggior rischio di riattivazione della ITL per un’aumentata suscettibilità legata al progressivo deterioramento delle condizioni generali (fisiche, sociali e psicologiche) e del sistema immunitario.
- La diagnosi della ITL viene stabilita con l’utilizzo di test immunologici: il test cutaneo tubercolinico di Mantoux (TST) e il test ematico Interferon-Gamma Release Assay (IGRA), dopo aver escluso la presenza di TB attiva è con la radiografia del torace che va sempre eseguita dopo il riscontro di una positività dei test immunologici.
- Pertanto, l’Infezione Tubercolare Latente è definita dal riscontro della positività di uno o di entrambi i test immunologici in assenza di segni clinici, radiografici e microbiologici di TB attiva.
- Il TST, conosciuto con il nome di test intradermico di Mantoux, è un esame che attesta la sensibilizzazione del sistema immunitario nei confronti del M. tuberculosis suscitando una reazione di immunità ritardata del IV tipo agli antigeni iniettati nel derma: la stimolazione delle cellule T della memoria attivano una risposta infiammatoria locale caratterizzata dalla liberazione di varie citochine che porta alla formazione di un caratteristico indurimento cutaneo.
- Il test si esegue iniettando per via intradermica nella faccia volare dell’avambraccio 0,1 ml di soluzione di derivato proteico purificato di tubercolina corrispondente a 5 UI di PPD (Purified Protein Derivative) e leggendo il test a distanza di 48-72 ore con la misurazione della papula mediante un righello millimetrato trasparente; deve essere misurata soltanto l’area dell’infiltrato, escludendo dalla misurazione l’area di eritema. In generale è consuetudine definire un test come positivo quando la risposta cutanea presenta un diametro minimo di 5 mm (Immagine 17). La significatività da attribuire al test, al fine della diagnosi di ITL, va valutata sulla base delle dimensioni del diametro riscontrato, rapportandolo a valori minimi stabiliti e diversificati sulla base del rischio del gruppo di appartenenza del soggetto esaminato. Pertanto il valore soglia del TST non è assoluto (Tabella 05). È importante affermare che la positività del test cutaneo alla tubercolina è indice d’infezione, ma non obbligatoriamente di malattia attiva, che invece viene valutata con la storia clinica, con la radiografia del torace e con altre indagini di laboratorio.
- Il test cutaneo diventa positivo dopo 1-2 mesi dalla prima infezione tubercolare e persiste solitamente per molti anni o anche per tutta la vita. Peraltro può essere falsamente negativo o falsamente positivo. La prima eventualità è dovuta a condizioni cliniche che compromettono la funzionalità del sistema immunitario cellulare: malattie esantematiche, morbo di Hodgkin, neoplasie sistemiche maligne, sarcoidosi, infezione da HIV, terapie immunosoppressive (cortisone, citostatici, farmaci biologici). Invece, le false positività possono essere riscontrate in soggetti sottoposti alla vaccinazione antitubercolare con BCG (bacillo di Calmette-Guérin) o nei casi d’infezione da Micobatteri non tubercolari. È importante riconoscere sia i falsi negativi per non omettere il trattamento della ITL nei soggetti immunocompromessi (come gli HIV), sia i falsi positivi per evitare un trattamento non necessario.
- Il test IGRA è basato sulla capacità dei linfociti T effettori, circolanti nel sangue, di produrre interferone-y (IFN-y) in seguito alla stimolazione in vitro con gli antigeni TE-specifici ESAT-6 e CFP-10, assenti nel vaccino BCG e nella maggior parte dei Micobatteri non tubercolari. Il test è correlato da un controllo negativo e da un controllo positivo per stabilire se il singolo test è valido. Il test IGRA va impiegato come esame integrativo, alternativo o sostitutivo, rispetto al TST. Gli IGRA attualmente disponibili sono due: il QuantiFERON Gold in-Tube (QTF-GIT) basato sul metodo ELISA, approvato dall’FDA nel 2007 e il T-SPOT.TB basato sul metodo ELISpot, approvato dall’FDA nel 2008.
- Il principale vantaggio del test IGRA è la non interferenza con il vaccino BCG. Infatti, i soggetti vaccinati BCG solitamente risultano TST positivi e IGRA negativi.
- L’approccio diagnostico alla ITL richiede l’adozione di una specifica condotta per le categorie di soggetti a rischio aumentato. I test sono utilizzati secondo cinque diverse combinazioni: TST da solo nelle nazioni a basso reddito (raccomandazione dell’OMS), l’IGRA da solo nelle nazioni con vaccinazione obbligatoria, l’ IGRA oppure il TST secondo le categorie da esaminare (raccomandazione degli Stati Uniti-CDC), la combinazione sequenziale TST seguito da un test IGRA soltanto se il TST è positivo (raccomandazione del Regno Unito-NICE), e infine l’utilizzo contemporaneo nei soggetti con immunità compromessa (Tabella 06). In quest’ultima categoria di persone a rischio aumentato la sensibilità di entrambi i test diagnostici è bassa e pertanto, eseguendoli entrambi, basta la positività di uno dei due per porre diagnosi di ITL.
Immagine 17
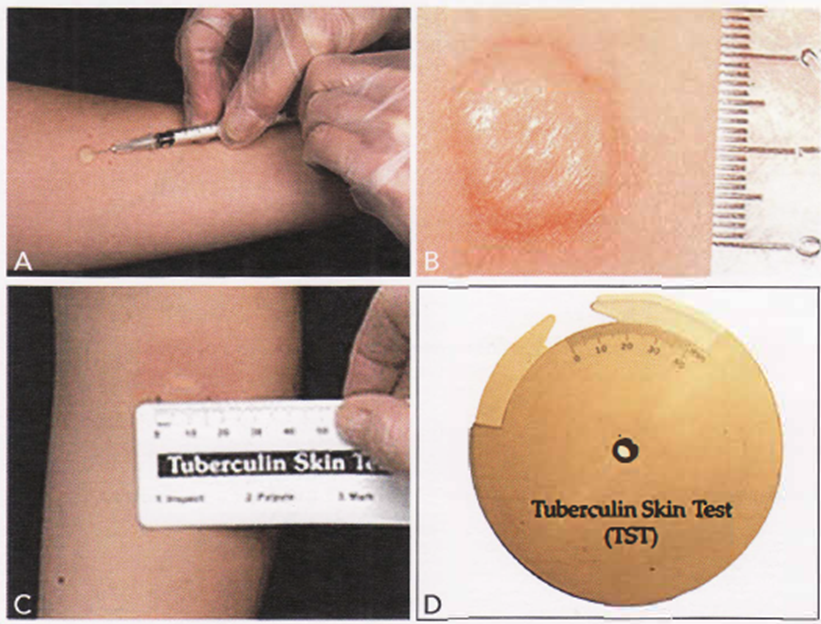
Immagine 17. Test intradermico di Mantoux. A) Intradermoreazione con pomfo. B) Esempio di Mantoux positiva: 20 mm. C, D) Regoli millimetrati per la lettura del test.
Tabella 04

Tabella 04. Categorie ad alto rischio di contrarre la ITL per esposizione ad ammalati di TB contagiosa.
Tabella 05

Tabella 05. Valore soglia di positività del diametro del TST nelle categorie a rischio.
Tabella 06
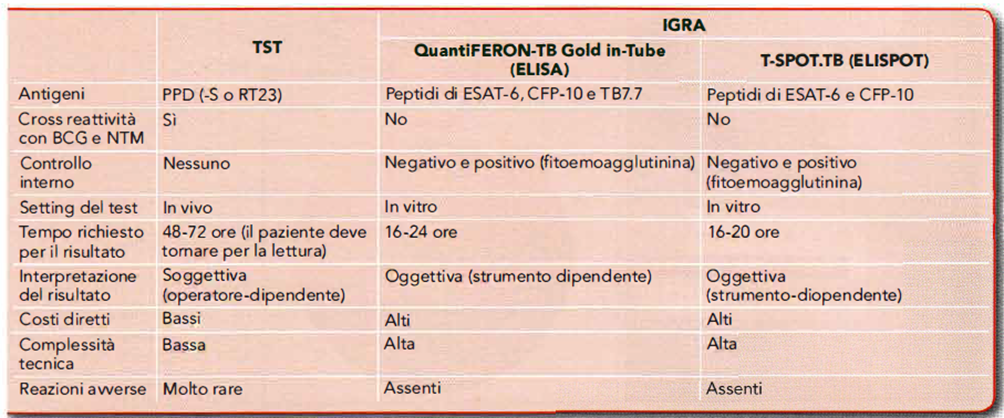
Tabella 06. Caratteristiche del TST e degli IGRA.
TRATTAMENTO DELL’INFEZIONE TUBERCOLARE LATENTE
- Il termine “trattamento”, preferito a quello di “prevenzione della TB attiva” usato per tanti anni, consiste nella somministrazione di uno o due farmaci antimicobatterici per un periodo definito, al fine di prevenire la possibile progressione dell’infezione a malattia tubercolare attiva in base al razionale di eliminare i bacilli “dormienti”, riducendo così la probabilità della loro riattivazione. Prima di iniziare il trattamento è indispensabile eseguire una radiografia del torace per escludere la presenza di Tubercolosi attiva.
- Il trattamento di scelta prevede la somministrazione di 300 mg di Isoniazide (INH) per sei mesi; secondo alcune Linee Guida (USA, Canada) la durata ottimale del trattamento è invece di nove mesi (Tabella 07). Nei bambini, nei soggetti HIV e in quelli da sottoporre a trapianto è preferibile la durata di nove mesi. Durante il trattamento deve essere sorvegliata la possibile tossicità epatica dell’Isoniazide in quanto un aumento delle transaminasi avviene nel 10- 20% delle persone; viene tollerato un aumento fino a cinque volte il limite massimo di normalità, ma se il soggetto diventa sintomatico per l’epatotossicità si tollera un aumento fino a tre volte i valori normali. La neuropatia periferica da INH si verifica nello 0,2% delle persone ed è più frequente nei diabetici, negli HIV, nei pazienti con insufficienza renale, negli alcolisti. Le compresse di piridossina (vitamina B6) sono raccomandate per prevenire la neuropatia.
- La monoterapia con Isoniazide è gravata da bassa aderenza sia per la lunga durata del trattamento che per il timore della comparsa di epatotossicità. Pertanto, per migliorare la compliance alla terapia si possono utilizzare schemi più brevi che prevedono l’utilizzo della rifampicina che può essere somministrata giornalmente per quattro mesi, oppure l’associazione rifampicina-Isoniazide solo per tre mesi; infine si possono impiegare rifapentina e isoniazide una volta la settimana per tre mesi.
Tabella 07

Tabella 07. Schemi terapeutici dell’Infezione Tubercolare Latente.