Dettagli
- Definizione
- Immagine 01
- Immagine 02
- Immagine 03
- Immagine 04
- Epidemiologia
- Segni e Sintomi
- Immagine 04
- Diagnosi
- Caso 005
- Caso 006
- Trattamento
- Caso 07
Difetto Interventricolare
Definizione
- Il difetto del setto ventricolare (VSD) è un’apertura congenita nel setto interventricolare del cuore e rappresenta fino al 50% delle malattie cardiache congenite. Embriologicamente la completa separazione dei due ventricoli avviene in momenti diversi: prima si sviluppa la parte muscolare del setto interventricolare, solo in secondo tempo, con lo sviluppo della sua parte membranosa, si completa la separazione fra le due cavità ventricolari.
- I difetti sono classificati in base alla loro posizione nel setto ventricolare:
- difetto peri-membranoso (che viene anche chiamato subaortico, infracristale o membranoso) è quello più frequente. La caratteristica che lo definisce è quella di essere localizzato nel setto membranoso nella zona del trigono fibroso del cuore dove aorta, mitrale e tricuspide sono tra loro in continuità;
- difetto di tipo muscolare, si definisce quel difetto i cui bordi sono completamente muscolari; può essere localizzato in qualsiasi parte della porzione trabecolata del setto interventricolare, è di variabile grandezza e prende il nome dalla posizione che occupa nel setto: apicale, muscolare anteriore o medio-muscolare. Può essere unico, ma a volte sono multipli (Swiss cheese). Nel neonato e nella prima infanzia la frequenza di questo tipo di difetto è piuttosto alta ma vi è una forte tendenza alla chiusura spontanea. Quando il difetto è ampio, la presenza di grossolane trabecole muscolari che lo attraversano può dare l’impressione di più di un difetto muscolare. Talvolta, se è inscritto nella parte più apicale del setto, è molto difficile localizzarlo poiché nascosto sia dalle trabecole muscolari (in questa zona molto numerose), sia dalla banda settale che passa anteriormente; secondo tipo di VSD più comune (5%-20% di tutti i VSD);
- difetto settale interventricolare tipo canale (chiamato anche difetto del setto inlet). Il setto del canale atrioventricolare è totalmente o parzialmente assente. Il difetto è localizzato vicino all’anello valvolare della mitrale e della tricuspide, sotto il lembo settale della tricuspide, il cui anello ne rappresenta il bordo superiore. Questi tipi di difetti sono rari (5%-7% di tutti i VSD), anche se l’incidenza riportata è del 15%-20% nelle popolazioni asiatiche;
- Difetto del setto conale o sottopolmonare (chiamata anche sopracristale infundibulare, dell’outlet ventricolare, sottoarterioso doppiamento connesso, conosettale o conale). È un difetto inscritto nella parte outlet del setto ed il suo bordo superiore è delimitato dalle valvole semilunari: dalla valvola polmonare e dall’anello valvolare aortico; in basso e a sinistra il margine è delimitato dal setto muscolare; costituiscono il 4%-5% di tutti i difetti cardiaci congeniti;
- Gerbode (raro), difetto che comporta una comunicazione diretta tra il ventricolo sinistro e l’atrio destro.
- Le principali complicazioni dei VSD non riparati ed emodinamicamente significativi includono:
- insufficienza cardiaca dovuta a sovra-circolazione polmonare;
- malattia vascolare polmonare;
- endocardite infettiva;
- sindrome di Eisenmenger (cianosi causata da shunt di sangue da destra a sinistra derivante da ipertensione polmonare di lunga durata e ipertrofia ventricolare destra);
- insufficienza aortica (da distorsione dei lembi della valvola aortica);
Immagine 01
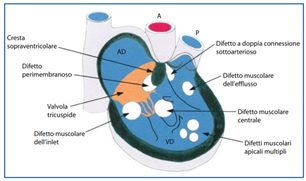
Immagine 01. Tipi differenti di difetto interventricolare visti dalla parte destra del cuore.
Immagine 02
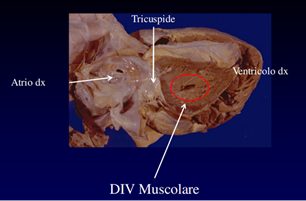
Immagine 02. Esempio di DIV Muscolare.
Immagine 03
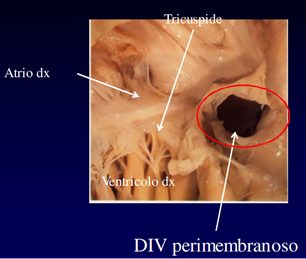
Immagine 03. Esempio di DIV perimembranoso.
Immagine 04
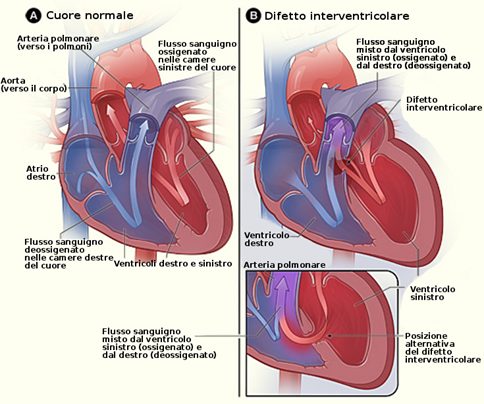
Immagine 04. DIA.
Epidemiologia
- Il difetto del setto ventricolare (VSD) è il più comune difetto congenito del cuore:
- l’incidenza riportata varia notevolmente a causa delle differenze nella sensibilità delle immagini, dell’età alla presentazione e del tipo di VSD, ed è stimata a 1,56-53,2 per 1.000 nati vivi;
Fattori di rischio
- fattori genetici, sono imporanti, infatti, è stato riscontrato:
- un tasso di ricorrenza nei parenti di primo grado:
- del 2% nella prole con difetto del setto ventricolare paterno (VSD);
- del 6%-10% nella prole con VSD materna;
- malattie e sindromi genetiche associate a VSD:
- sindrome di Down (trisomia 21);
- sindrome di DiGeorge (22q11.2 sindrome da eliminazione);
- sindrome di Turner (45X);
- sindrome di Holt-Oram e mutazione TBX5 associata;
- un tasso di ricorrenza nei parenti di primo grado:
- esposizione ambientale:
- malattie metaboliche materne non trattate come il diabete e la fenilchetonuria (PKU);
- farmaci teratogeni come l’alcol e la fenitoina, esposizione materna al litio durante il primo trimestre;
- infezioni materne come la rosolia;
- l’obesità materna durante la gravidanza associata ad un aumento del rischio di VSD congenito nel neonato rispetto alla gravidanza nella madre di peso normale;
Fisiopatologia
- Il difetto del setto ventricolare (VSD) deriva molto probabilmente da interazioni multifattoriali, compresa la predisposizione genetica ereditaria e le cause ambientali;
- I VSD acquisiti sono molto più rari nelle popolazioni pediatriche e possono essere dovuti a cause iatrogene, traumi contundenti o penetranti, o occasionalmente all’infarto post-miocardico;
- I principali fattori che influenzano il significato emodinamico del difetto del setto ventricolare (VSD) sono:
- dimensioni e posizione del VSD;
- resistenza vascolare polmonare;
- pressione relativa nei ventricoli destro e sinistro;
- insufficienza aortica associata;
- ostruzione del tratto di deflusso associato;
- VSD è una malformazione cardiaca congenita che si manifesta durante lo sviluppo fetale:
- l’elevata resistenza vascolare polmonare normalmente presente al momento della nascita limiti lo shunt da sinistra a destra, anche con VSD di grandi dimensioni;
- lo shunt da sinistra a destra inizia con la caduta della resistenza polmonare nelle prime ore di vita;
- la resistenza vascolare polmonare può rimanere alta con un grande difetto, a causa della costrizione persistente delle arteriole polmonari, con conseguente elevata pressione polmonare;
- la resistenza vascolare poi diminuisce nel corso di diverse settimane a causa di alcuni cambiamenti:
- shunt permanente da sinistra a destra;
- incremento del flusso sanguigno polmonare;
- sviluppo della circolazione polmonare e dell’insufficienza cardiaca;
- L’ipertensione polmonare deriva principalmente da un aumento della pressione e del flusso verso la vascolarizzazione polmonare;
- nei neonati con grandi VSD e grandi shunt da sinistra a destra, la sovra-circolazione polmonare provoca sintomi di insufficienza cardiaca;
- nel tempo la resistenza vascolare polmonare può aumentare e causare ipertensione polmonare, portando alla sindrome di Eisenmenger;
Segni e Sintomi
- 80%-90% dei neonati con difetto ventricolare piccolo-moderato (VSD) presenta sintomi solo lievi (potrebbe presentare un soffio al cuore);
- i neonati con VSD da moderata a grande non diagnosticata possono sviluppare sintomi, di solito settimane/diversi mesi dopo la nascita, di sovra-circolazione polmonare e/o insufficienza cardiaca, tra cui:
- respiro affannoso, respirazione rapida e difficoltà respiratoria;
- difficoltà di respirazione e/o sudorazione durante l’alimentazione;
- scarsa alimentazione;
- mancata crescita;
- il bambino più grande o nell’adulto con la sindrome di Eisenmenger, può presentare:
- palpitazioni;
- dispnea da sforzo;
- intolleranza all’esercizio;
- edema;
- cianosi progressiva;
- sincope;
- dolore al petto;
- emottisi;
- nell’adulto con VSD non riparato (improbabile che si presenti in età adulta senza una valutazione o diagnosi preliminare), la presentazione potrebbe includere:
- intolleranza all’esercizio fisico dovuta a malattia vascolare polmonare in progressione, o cianosi se progressione alla sindrome di Eisenmenger;
- febbre dovuta a endocardite infettiva;
- Segni e sintomi comuni di VSD nei neonati includono:
- eccessiva stanchezza;
- respirazione rapida e superficiale;
- difficoltà di respirazione e/o sudorazione durante l’alimentazione;
- scarso apporto calorico e mancata crescita;
- scarso aumento di peso;
- I bambini più grandi o gli adulti con la sindrome di Eisenmenger con un VSD significativo non diagnosticato possono presentare dispnea da sforzo, svenimenti, emottisi o cianosi.
Esame Obbiettivo
- valutare l’aspetto generale, i segni vitali e la crescita;
- cianosi può comparire nei pazienti con la sindrome di Eisenmenger;
- caratteristiche del soffio cardiaco all’auscultazione:
- murmure tipicamente pansistolici o olo-sistolici;
- i piccoli difetti del setto ventricolare (VSD) possono essere più rumorosi, sono spesso molto acuti, e occasionalmente si può notare anche un fremito;
- grandi VSD possono presentare un murmure con:
- qualità costante e poca variazione durante tutto il ciclo cardiaco;
- rombo diastolico all’apice dovuto all’aumento dell’afflusso mitralico;
- il grado e la posizione del mormorio possono variare con la velocità e la quantità di flusso, la posizione del VSD e le condizioni associate:
- i VSD muscolari possono essere rilevati sul bordo sternale inferiore sinistro e le caratteristiche del mormorio possono variare con la contrazione muscolare durante la sistole;
- Le VSD perimembrane possono avere un click sistolico associato all’aneurisma della valvola tricuspide;
- difetti infundibolari possono essere rilevati sul bordo sternale superiore sinistro e shunt vicino alla valvola polmonare;
- VSD con insufficienza aortica può essere rilevato come murmure diastolico decrescente al margine sternale sinistro con il paziente seduto e inclinato in avanti;
- Il VSD associato o che contribuisce al rigurgito tricuspidale può avere un soffio sistolico sul bordo sternale inferiore sinistro o destro inferiore destro;
- il murmure può non essere presente nei pazienti con VSD di grandi dimensioni senza shunt e nei pazienti con sindrome di Eisenmenger con shunt da destra a sinistra;
- palpazione del precordium:
- sovraccarico del volume del ventricolo sinistro con impulso spostato lateralmente e/o aumento della componente polmonare nel II tono del cuore suggerisce un VSD più grande;
- il sollevamento ventricolare destro e/o la forte componente polmonare del secondo suono cardiaco suggeriscono la sindrome di Eisenmenger;
- in adulto con VSD non riparato:
- murmure sistolico, di solito più forte sul bordo sternale inferiore sinistro:
- soffio pansistolico se la pressione ventricolare destra è bassa;
- più corto, più morbido e con picco più basso con l’aumento della pressione ventricolare destra;
- mormorio sistolico precoce molto acuto con piccolo VSD muscolare (termina in sistole precoce a causa della chiusura del difetto durante la contrazione muscolare);
- nuovo mormorio diastolico di rigurgito aortico dovuto al prolasso della valvola aortica;
- murmure sistolico, di solito più forte sul bordo sternale inferiore sinistro:
Immagine 04
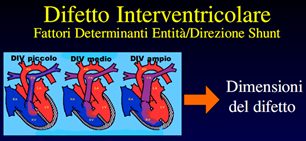
Immagine 04. Le dimensioni del difetto influenzano l’entità e la direzione dello shunt.
Diagnosi
- difetto del setto ventricolare sospetto (VSD) nei neonati con presentazione clinica di:
- caratteristico murmure del cuore;
- tachipnea;
- dispnea durante l’alimentazione;
- difficoltà di alimentazione e scarso aumento di peso;
- L’ecocardiografia è necessaria per confermare e chiarire il tipo di VSD, nonché per valutare la presenza di ulteriori malattie cardiache congenite associate;
- la diagnosi prenatale può essere fatta anche mediante ecocardiografia fetale;
- la diagnosi iniziale è rara negli adulti e può essere confermata con l’ecocardiografia;
- nei neonati e nei bambini, l’imaging può confermare il difetto del setto ventricolare (VSD) dopo l’esame fisico:
- l’ecocardiografia è il metodo preferito per la diagnostica per immagini;
- il cateterismo cardiaco può essere utilizzato nei casi di malattie cardiache congenite complesse;
- la risonanza magnetica può essere utilizzata per difetti di immagine prima e dopo l’intervento chirurgico;
- altri test che possono rilevare solo le caratteristiche di un VSD di grandi dimensioni:
- radiografia del torace (può anche rilevare la sindrome di Eisenmenger);
- elettrocardiografia;
- la cateterizzazione cardiaca in genere non è necessaria con la maggior parte dei VSD
Ecocardiografia (test di conferma)
- Per valutare la dimensione del difetto e il volume dello shunt;
- I risultati dell’ecografia Doppler di un flusso sanguigno patologico da sinistra a destra possono aiutare a diagnosticare difetti ventricolari minori;
Caso 005
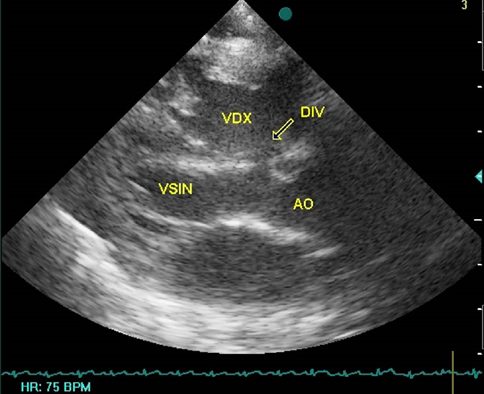
Caso 005. Ecocardiografia: DIV sotto-aortico
Caso 006
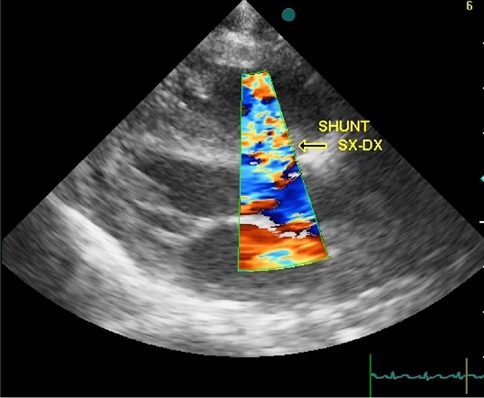
Caso 06. Ecocardiografia color-doppler: visibile uno shunt sx-dx a bassa velocità.
Radiografia del torace
- Miglioramento delle marcature vascolari polmonari;
- Allargamento atriale sinistro e ventricolare;
- Nelle fasi successive, ingrandimento del ventricolo destro e dell’arteria polmonare (a causa dell’elevato PVR);
Elettrocardiografia (ECG)
- nei pazienti con un piccolo difetto del setto ventricolare (VSD), l’elettrocardiogramma può apparire normale:
- i risultati dell’elettrocardiogramma che possono suggerire che VSD includa:
- ipertrofia ventricolare sinistra dovuta al carico volumetrico;
- allargamento dell’atrio sinistro;
- ipertrofia ventricolare destra dovuta all’ipertensione;
- polmonare o all’ostruzione del tratto di efflusso polmonare;
- deviazione dell’asse destro e allargamento atriale destro dovuto all’elevata pressione dell’arteria polmonare;
- con VSD di grandi dimensioni e significativa ipertensione arteriosa polmonare:
- ipertrofia biventricolare;
- ipertrofia ventricolare destra isolata se il tratto di efflusso del ventricolo sinistro è diminuito a causa della riduzione dello shunt da sinistra a destra;
- con VSD non riparata, soprattutto nei pazienti con aumento della pressione arteriosa polmonare
- complessi ventricolari prematuri (PVC) (isolati, couplets e multiformi);
- tachicardia ventricolare non sostenuta;
Trattamento
- alcuni difetti del setto ventricolare (VSD) diminuiranno spontaneamente di dimensione o si chiuderanno con una gestione conservativa;
- gestione non chirurgica di VSD:
- I VSD di medie e grandi dimensioni possono richiedere una gestione medica, tra cui:
- nei neonati sintomatici con ipertensione polmonare, diuretici con o senza inibitori dell’enzima di conversione dell’angiotensina;
- in pazienti asintomatici senza ipertensione polmonare ma con sovraccarico del cuore sinistro, può essere indicata una gestione conservativa (vigile attesa);
- nei neonati con VSD complicato da insufficienza cardiaca considerare diuretici, digossina, riduzione del post-carico e chirurgia precoce se l’insufficienza cardiaca non può essere controllata dal punto di vista medico;
- profilassi antibiotica dell’endocardite, se necessario;
- I VSD di medie e grandi dimensioni possono richiedere una gestione medica, tra cui:
- chiusura chirurgica o catetere di VSD:
- l’intervento non può essere indicato in piccoli VSD;
- La decisione di eseguire la chiusura chirurgica o transcatetere di un VSD si basa su molteplici fattori, tra cui:
- posizione del VSD;
- età del paziente;
- presenza e grado di ipertensione polmonare;
- grado di ingrandimento della camera del cuore;
- presenza di prolasso aortico e rigurgito;
- presenza di altri difetti cardiaci;
- tempi di chiusura:
- immediato in pazienti con VSD di grandi dimensioni e scompenso cardiaco incontrollabile;
- precoce (età 3-6 mesi) nei neonati con insufficienza cardiaca refrattaria alla gestione medica, o per lo sviluppo di ipertensione polmonare significativa o ≥ 1 episodio di endocardite;
- all’età di 1-2 anni in pazienti con SEV moderate o grandi, o pressioni polmonari del 50%-66% delle pressioni sistemiche;
- all’età di 2-4 anni per difetti moderati che difficilmente si chiudono, o piccoli difetti di uscita con dilatazione cardiaca sinistra, pressione arteriosa polmonare normale e shunt da sinistra a destra > 1,5:1, o prolasso della valvola aortica (con o senza insufficienza aortica);
- ogni volta che il prolasso della valvola aortica si traduce in un’insufficienza aortica significativa o progressiva;
- procedure chirurgiche:
- la chiusura con patch (toppe) attraverso la sternotomia con bypass cardiopolmonare è il metodo chirurgico preferito per la chiusura di VSD;
- bande assorbibili o dilatabili con palloncino possono essere indicate in pazienti con difetti muscolari multipli per ridurre il flusso sanguigno polmonare;
- la chiusura del transcatetere può essere indicata in VSD muscolari e difetti che possono essere di difficile accesso chirurgico:
- la chiusura minimamente invasiva del periventricular device ha riferito di avere una buona sicurezza ed efficacia a breve e medio termine nei bambini con VSD perimembranaus;
- Il dispositivo Amplatzer VSD transcatetere Amplatzer ha riferito di essere sicuro ed efficace per la chiusura di VSD residui post-chirurgici;
Caso 07
