Dettagli
- Il controllo della respirazione
- La meccanica della respirazione
- Diffusione e trasporto dei gas
- Equilibrio acido-base
- Funzioni non respiratorie del polmone
Fisiologia dell’apparato respiratorio
- Il polmone è un organo dinamico la cui principale funzione è di garantire l’apporto di ossigeno al sangue dall’ambiente esterno e di rimuovere l’anidride carbonica dall’organismo.
- L’ossigeno è indispensabile per garantire energia all’organismo e per il corretto svolgimento di diversi processi metabolici mentre l’anidride carbonica è ottenuta dai processi di produzione di energia.
- Oltre alle funzioni puramente respiratorie, il polmone svolge altre funzioni quali meccanismi di difesa dagli agenti esterni, la regolazione dell’equilibrio acido-base, l’azione di filtro ematico, il metabolismo e la sintesi di alcuni composti e infine funge da serbatoio di sangue.
- Il processo respiratorio si realizza tramite la complessa e coordinata interazione di diverse componenti anatomiche e tissutali quali il sistema nervoso, il sistema muscolo-scheletrico, il sistema vascolare, le vie aeree e il parenchima polmonare.
- Una corretta valutazione dell’attività respiratoria è indispensabile al fine di riconoscere e diagnosticare precocemente la maggior parte delle patologie polmonari per garantire la terapia appropriata.
Il controllo della respirazione
- La regolazione della respirazione ha lo scopo di mantenere entro determinati range di valori il pH e le pressioni parziali di O2 e CO2 attraverso l’interazione di processi nervosi, chimici e meccanici.
- L’atto respiratorio è spontaneo e inconscio e origina da un complesso sistema di impulsi provenienti dal tronco encefalico.
- I tre elementi fondamentali (Immagine 01) del controllo respiratorio sono organizzati a feedback e sono:
- il sistema sensoriale (chemorecettori e recettori polmonari), che raccolgono informazioni;
- il controllore, localizzato a livello del sistema nervoso centrale, che coordina le informazioni;
- il sistema effettore (muscoli respiratori), che sostiene la ventilazione.
Immagine 01
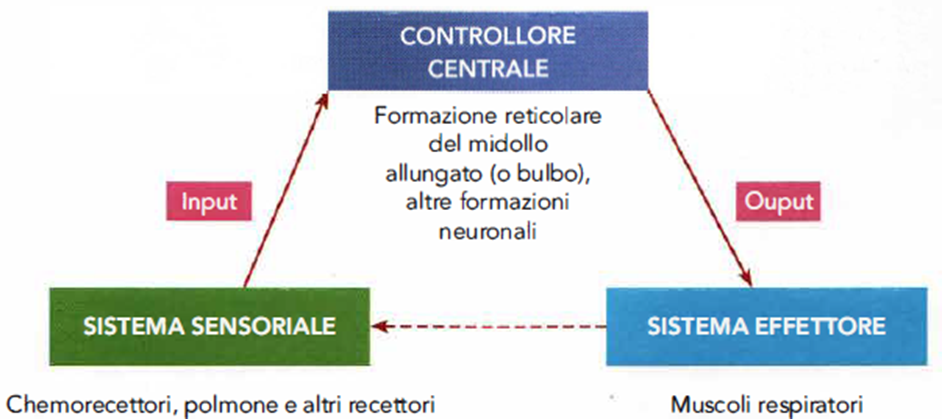
Immagine 01. Triade del controllo del respiro.
Il sistema sensoriale
- Il sistema sensoriale è costituito da chemorecettori centrali, periferici e polmonari.
- I chemorecettori centrali sono situati vicino alla superficie ventrale del midollo allungati, in corrispondenza del pavimento del IV ventricolo, e vengono attivati da modificazioni nella concentrazione di ioni H+ presenti nel liquido extracellulare cerebrale (LEC).
- L’incremento della concentrazione di ioni H+ determina l’aumento della ventilazione, al contrario la diminuzione ne comporta una inibizione.
- I chemorecettori centrali sono circondati dal LEC la cui composizione è regolata principalmente dal liquido cefalorachidiano (LCR) e in parte dal flusso ematico e dal metabolismo locale.
- Il liquor è separato dal sangue dalla barriera emato-encefalica che è impermeabile agli ioni H+ e HCO3- mentre risulta facilmente attraversabile dalla CO2, con conseguenze importanti nella regolazione della ventilazione.
- L’aumento della pCO2 nel sangue, infatti, determina la diffusione della stessa nel LRC con liberazione di ioni H+.
- Questi, determinando variazioni sul pH del liquor, stimolano i chemorecettori che inducono un aumento di frequenza della ventilazione (iperventilazione) che comporta a sua volta una riduzione della pCO2 sia nel sangue che nel liquor.
- È importante sottolineare che i chemorecettori centrali sono sensibili solo alla CO2 liquorale che ha una capacità tamponante minore del sangue a causa dello scarso contenuto proteico, questo si determina quindi una rapida variazione di pH a ogni cambiamento della pCO2.
- Una riduzione prolungata del pH liquorale è compensata dal trasporto di ioni HCO3- attraverso la barriera ematoencefalica. In pazienti con ipercapnia cronica quindi si ha una più rapida correzione del pH liquorale rispetto a quello ematico, di conseguenza la PaCO2 pur essendo elevata non provocherà uno stimolo all’iperventilazione. Tutto ciò comporta che in questo caso l’unico stimolo sarà proprio l’ipossiemia che per questo sarà da correggere con cautela perché una somministrazione di una miscela ricca di ossigeno potrebbe ridurre fortemente lo stimolo alla ventilazione provocando un coma ipercapnico.
- I chemorecettori periferici sono situati nei glomi carotidei e aortici e rispondono a variazioni della pO2, della pCO2 e del pH ematici.
- La risposta alla CO2 ematica è più rapida ma meno importante rispetto a quella ventilatoria centrale.
- Nella risposta ventilatoria all’O2 invece i chemocettori periferici assumono un ruolo predominante determinando l’iperventilazione quando la pO2 scende al di sotto di 60 mmHg.
- Una riduzione del pH, indipendentemente dalla possibile causa respiratoria o metabolica, attiva questi chemorecettori incrementando la ventilazione.
- Alterazioni dell’equilibrio tra CO2, O2 e pH nel sangue possono determinare la comparsa di respiri definiti “patologici” quali:
- Respiro di Cheyne-Stokes, caratterizzato da periodi di apnea di 15-20 secondi intervallati da periodi di iperventilazione. Si riscontra in pazienti con danno cerebrale o cardiopatia grave.
- Respiro di Kussmaul, caratterizzato, da una inspirazione forzata, una pausa e una espirazione breve seguita da una pausa. Si riscontra in pazienti con acidosi diabetica e uremia.
- Respiro di Biot, caratterizzato da respiri profondi e superficiali intervallati da pause irregolari. Si riscontra in pazienti con lesioni cerebrali.
- Respiro di Falstaff, caratterizzato da perdita del tono muscolare in pazienti obesi con collasso della faringe con conseguente flusso d’aria turbolento e tipico russamento. Si riscontra in pazienti con sindrome delle apnee ostruttive del sonno.
- Respiro apneustico, caratterizzato da una pausa in fase inspiratoria. Si riscontra in pazienti con lesioni del 1/3 rostrale del ponte.
- A livello polmonare sono inoltre presenti diversi tipi:
- recettori polmonari da stiramento, situati nella muscolatura liscia delle vie aeree. Si attivano in risposta alla distensione del polmone inducendo un rallentamento della frequenza respiratoria per aumento del tempo espiratorio (riflesso da insufflazione di Hering-Breuer), impedendone la sovradistensione.
- recettori da irritazione, situati tra le cellule epiteliali delle vie aeree. Svolgono un ruolo nella broncocostrizione se stimolati da gas nocivi, fumo di sigaretta, polveri inalate e aria fredda.
- recettori J (o Juxtacapillari), sono situati nelle pareti alveolari in vicinanza dei capillari e sono costituiti dalle terminazioni nervose delle fibre non mieliniche C. Possono indurre una respirazione rapida e superficiale se stimolati da sostanze chimiche presenti nel circolo polmonare, invece in caso di una stimolazione molto intensa inducono apnea.
- recettori C bronchiali, che innervano la circolazione bronchiale e inducono respirazione rapida e superficiale, broncocostrizione e secrezione di muco in caso di stimolazione da parte di prodotti chimici.
- Altri recettori sono i recettori nasali e delle vie aeree superiori, i recettori articolari e muscolari, i barocettori arteriosi, termocettori e nocicettori.
- La risposta ventilazione è quindi determinata dall’ integrazione di tutti i segnali provenienti da chemocettorie meccanocettori, centrali e periferici che monitorano costantemente tutti i paramentri illustrati.
Il controllore
- A livello del sistema nervoso centrale sono localizzati dei gruppi di neuroni che regolano la natura periodica dell’inspirazione e dell’espirazione.
- Nella formazione reticolare del midollo allungato (o bulbo) è presente il centro respiratorio bulbare. Nella regione ventrale e laterale del centro respiratorio bulbare sono presenti dei neuroni che formano il complesso Pre-Botzinger, il quale sembra essere deputato alla genesi del ritmo respiratorio.
- Nella regione dorsale si trova un gruppo di neuroni che costituiscono il gruppo respiratorio dorsale, associato principalmente all’inspirazione, mentre un altro gruppo, il gruppo respiratorio ventrale, è correlato all’espirazione; questi due gruppi neuronali, attivandosi periodicamente, sono responsabili del ritmo della ventilazione.
- A livello del ponte invece sono presenti altri due centri: il centro apneustico e il centro pneumotassico.
- Il primo rappresenta è un “attivatore” del centro inspiratorio ed è a sua volta controllato dal secondo che periodicamente lo inibisce stimolando il centro espiratorio. Su questi centri, è possibile comunque un controllo da parte della corteccia cerebrale che può modulare l’attività del tronco encefalico, qualora si renda necessaria una iper o ipoventilazione volontaria, oppure eseguire comuni azioni come parlare, tosse volontaria o apnee temporanee.
Il sistema effettore
- I muscoli respiratori comprendono il diaframma, i muscoli intercostali e i muscoli accessori (sternocleidomastoideo). Nel controllo della ventilazione è di fondamentale importanza che ci sia coordinazione tra i diversi gruppi muscolari e ciò è assicurato dal centro respiratorio.
La meccanica della respirazione
- Da un punto di vista meccanico possiamo considerare il polmone e la parete toracica come una pompa caratterizzata da proprietà elastiche, da resistenze al flusso e da inerzia. La ventilazione alveolare è il risultato di variazioni di pressioni tra l’aria atmosferica e gli alveoli; l’aria infatti si muove dalle regioni a più alta pressione verso quelle a pressione più bassa. Quando tra l’atmosfera e gli alveoli si stabilisce un gradiente pressorio sufficiente a vincere la resistenza al flusso offerta dalle vie aeree di conduzione, l’aria entra nei polmoni.
Inspirazione ed espirazione
- Il più importante muscolo inspiratorio è il diaframma, che consiste in una sottile lamina muscolare a forma di cupola, innervata dal nervo frenico. Durante la respirazione tranquilla il livello del diaframma si muove generalmente di circa 1 cm, ma nelle inspirazioni ed espirazioni forzate tale escursione può superare i 10 cm. Gli altri muscoli coinvolti nell’inspirazione sono gli intercostali esterni, innervati dai nervi intercostali del midollo spinale (emergenti al medesimo livello), che contraendosi provocano un aumento dei diametri laterale e antero-posteriore del torace. I muscoli accessori dell’inspirazione, quali scaleno e sternocleidomastoideo, vengono reclutati durante l’inspirazione forzata. L’attivazione di questi muscoli determina un aumento della negatività intrapleurica con conseguente aumento del gradiente di pressione transmurale, ciò comporta una riduzione della pressione endo-alveolare al di sotto di quella atmosferica e quindi l’ingresso di aria negli alveoli.
- L’espirazione a riposo invece è un atto passivo per l’elasticità del polmone e della parete toracica che, dopo essere stati espansi durante l’inspirazione attiva, tendono a ritornare alla loro posizione di equilibrio.
- In corso di espirazione forzata si contraggono i muscoli addominali (obliqui interno ed esterno, trasverso dell’addome) e gli intercostali interni.
Ritorno elastico del polmone
- Le proprietà elastiche del polmone sono determinate dalle proprietà meccaniche del tessuto polmonare (fibre elastiche e collagene) e dalla forza di tensione superficiale (T) del film liquido che riveste gli alveoli. Il surfattante è una miscela di fosfolipidi prodotta dagli pneumociti di secondo tipo e la sua funzione è di ridurre la tensione superficiale evitando il collasso polmonare. Questo meccanismo è fondamentale perché gli alveoli mantengano la propria stabilità e il polmone acquisti le sue caratteristiche di compliance.
Resistenze delle vie aeree
- La resistenza delle vie aeree rappresenta la quota principale delle resistenze totali ed è dovuta all’attrito delle molecole gassose tra loro e sulle pareti. Esiste una relazione tra resistenza, pressione e flusso così espressa: R= ΔP/F dove ΔP(cm H2O) è la differenza di pressione tra gli alveoli e la bocca ed F (L/m) è il flusso.
- Il flusso aereo può essere:
- laminare (direzione retta delle particelle, parallela alla superficie interna del tubo) e presente solo nelle vie aeree più piccole con velocità di flusso bassa;
- turbolento (movimento vorticoso delle particelle), in presenza di valori elevati di flusso aereo, densità del gas e raggio del tubo;
- di transizione (flusso laminare misto a flusso turbolento), presente nei punti di ramificazione o distalmente a ostruzioni bronchiali.
- La resistenza totale al flusso è localizzata prevalentemente nelle vie aeree superiori (naso, turbinati, orofaringe, nasofaringe). Durante la normale espirazione la resistenza offerta dalle piccole vie aeree è minima, pertanto la maggiore resistenza al flusso aereo risiede nei bronchi di maggior calibro.
Resistenze tissutali
- Le resistenze tissutali sono dovute all’attrito che insorge durante il movimento dei tessuti polmonari, dei due foglietti pleurici fra loro, della gabbia toracica, del diaframma e dell’addome. Questi tessuti sono materiali viscoelastici, proprietà per cui quando deformati non restituiscono completamente l’energia applicata, ma una parte di essa viene dispersa in calore.
- Le resistenze tissutali costituiscono di solito il 20% delle resistenze totali in soggetti giovani normali, sebbene possano aumentare in alcune malattie.
Compressione dinamica delle vie aeree
- Per effetto delle forze e delle resistenze, i bronchi vengono dilatati durante l’inspirazione e ristretti durante l’espirazione. Il calibro bronchiale dipende sia dalla P che agisce sulla sua parete esterna (pressione pleurica= PPL) che dalla pressione all’interno delle vie aeree (pressione alveolare = Palv) e dalla compliance polmonare e bronchiale (pressione transmurale = Palv – PPL). Durante una espirazione forzata, il gradiente pressorio transmurale che contribuisce a mantenere pervie le vie aeree è più basso.
- Queste possono venire lievemente compresse per cui la resistenza al flusso sarà più grande rispetto a quella opposta durante l’espirazione passiva (compressione dinamica delle vie aeree). Inoltre, nel corso dell’espirazione, riducendosi il volume polmonare, ci sarà una più bassa pressione di ritorno elastico e la differenza tra Palv e PPL diminuirà con una riduzione della “driving pressure”, la pressione che spinge l’aria fuori dai polmoni.
- Durante l’espirazione forzata, per ogni istante, c’è un punto lungo le vie aeree dove la pressione all’interno è esattamente uguale a quella presente all’esterno con gradiente pressorio transmurale pari a zero (punto di uguale pressione = EPP). Oltre l’EPP il gradiente pressorio transmurale è negativo ed essendo la pressione all’esterno maggiore di quella all’interno, la via aerea si collasserà.
- Con il persistere dello sforzo espiratorio, l’EPP si sposta dalle vie aeree più grandi a quelle più piccole per la riduzione della pressione di ritorno elastico alveolare in relazione al ridotto volume polmonare.
- La chiusura delle piccole vie aeree avviene nei soggetti sani solo a volumi molto bassi, ma il volume di chiusura può insorgere a volumi polmonari più alti nei pazienti con broncopneumopatia cronica ostruttiva (BPCO).
Interazione tra polmone e parete toracica
- La forza del ritorno elastico polmonare è inversamente proporzionale e quella del ritorno elastico della parete toracica, poichè il primo favorisce il collassamento polmonare, mentre il secondo tende a espandere la gabbia toracica. Il polmone quindi si trova in una situazione di equilibrio tra queste due forze, che cambia nel corso degli atti respiratori.
- A volume residuo (VR) il ritorno elastico della gabbia toracica è diretto all’esterno ed è notevole, mentre il ritorno elastico del polmone diretto in senso opposto è piccolo, essendo il polmone stesso vicino al suo volume minimo.
- A capacità funzionale residua (CRF), quando i muscoli inspiratori sono completamente rilassati, il ritorno elastico della gabbia toracica e del polmone sono di uguale entità e opposti, cosicché la differenza tra la PPL e la pressione alla superficie della gabbia toracica è uguale a zero (Immagine 02).
- Approssimativamente a circa il 70% della capacità polmonare totale (CPT) la pressione di ritorno elastico della parete toracica è pari a zero.
- A capacità polmonare totale sia la forza di ritorno elastico polmonare che della parete toracica si oppongono a un’ulteriore inspirazione.
- Questo ha delle ripercussioni sulla forza necessaria dei muscoli inspiratori ad attivare gli atti inspiratori che evidentemente sarà minima a CRF e via via maggiore quando si supera il 70% della CPT.
Compliance ed elastanza
- La compliance (C) o distensibilità è proporzionale alla capacità del polmone a lasciarsi distendere, mentre l’elastanza (E) è proporzionale alla capacità del polmone a opporsi alla sua distensione (1/C). Le proprietà elastiche del polmone possono quindi essere rappresentate indifferentemente da una delle due variabili.
- La C viene valutata ponendo in relazione la modificazione di volume di aria nei polmoni (DV) con la variazione di pressione transpolmonare (DP) secondo la formula C = DV/DP e corrisponde nell’uomo sano a circa 200 ml/cm H20. Può essere misurata in condizioni statiche, in assenza di flusso aereo, o durante respirazione libera e prende il nome rispettivamente di C statica e C dinamica.
- La compliance viene misurata in laboratorio valutando la P intraesofagea (mediante posizionamento di catetere esofageo) che segue fedelmente le variazioni della PPL ed è maggiore a bassi volumi polmonari, riducendosi invece notevolmente a quelli più elevati. La sua registrazione inspiratoria ed espiratoria descrive un caratteristico aspetto denominato isteresi (Immagine 03), tipico delle strutture elastiche e in parte correlato alle proprietà del surfattante, in parte alla chiusura delle vie aeree ai bassi volumi polmonari.
- Essa aumenta fisiologicamente con l’età ed è aumentata nell’enfisema per il ridotto ritorno elastico dovuto alla perdita della normale architettura del parenchima polmonare, mentre è ridotta nelle fibrosi.
- Anche la forza elastica della parete toracica si esprime con un valore di C che è alterato in corso di malattie della parete come la cifoscoliosi e che si modifica nel corso di malattie respiratorie caratterizzate da variazione della capacità residua funzionale (CRF), come nel caso dell’enfisema polmonare.
Immagine 02

Immagine 02. Curve P/V della parete toracica e dei polmoni ai vari volumi polmonari.
Immagine 03

Immagine 03. Curve P/V inspiratorie ed espiratorie (isteresi).
Lavoro respiratorio
- Per muovere il polmone e la parete toracica è necessario un lavoro.
- L’aria entra nei polmoni a causa del lavoro svolto dai muscoli inspiratori che contraendosi espandono la gabbia toracica creando il gradiente pressorio adeguato tra l’interno degli alveoli e l’ambiente esterno. Questo lavoro serve per vincere le resistenze viscose (lavoro resistivo) e le resistenze elastiche (lavoro elastico).
- Il lavoro resistivo è determinato dalla resistenza delle vie aeree al flusso dell’aria e dalle resistenze tissutali. Le resistenze tissutali aumentano per lo più nelle patologie che coinvolgono la trama parenchimale polmonare come le fibrosi polmonari. Le resistenze delle vie aeree aumentano in tutte le malattie ostruttive bronchiali.
- Il lavoro elastico è determinato dalle proprietà elastiche della parete toracica, del polmone e dalla tensione superficiale all’interno degli alveoli e aumenta in alcune patologie della gabbia toracica come nelle cifoscoliosi, nell’obesità, nelle malattie restrittive in generale e nelle patologie che coinvolgono il surfattante. Il lavoro complessivo è calcolato come la variazione di pressione transpolmonare moltiplicata per la variazione di volume di aria che entra nei polmoni. La pressione transpolmonare è la differenza tra la pressione pleurica e la pressione all’interno del polmone.
- L’espirazione invece è un fenomeno passivo. Il ritorno elastico del polmone, quando i muscoli inspiratori si rilassano, provoca un innalzamento della pressione alveolare (Palv) rispetto a quella della bocca e di conseguenza la fuoriuscita di aria dai polmoni.
- Le forze coinvolte sono rappresentate da:
- ritorno elastico polmonare;
- muscoli espiratori per una ventilazione che superi 40 l/min;
- ritorno elastico della gabbia toracica;
- resistenze dinamiche.
Ventilazione e volumi polmonari
- La ventilazione è determinata dal prodotto della profondità dei respiri e dalla loro frequenza. Questi parametri possono variare entro limiti assai ampi in dipendenza delle varie necessità dell’organismo.
- La ventilazione totale è calcolata moltiplicando il volume di un atto respiratorio a riposo denominato volume corrente (VC di circa 500 cc), per il numero degli atti respiratori al minuto (tra 14 e 16 al minuto). Una quota del VC (circa 150 cc) non raggiunge il compartimento gassoso alveolare dove avviene lo scambio dei gas rimanendo intrappolata nelle vie aeree di conduzione (volume dello spazio morto anatomico o VD). Il volume di gas che entra nella zona respiratoria in un minuto.
- L’effettiva ventilazione alveolare (V alv) va calcolata sottraendo il VD al VC secondo la formula: V alv = (VC-VD) x FR ad esempio in un soggetto normale: (500-150) x 15 = 5250 cc/min.
- La riduzione patologica della Valv determina un incremento della concentrazione arteriosa della CO2 (ipercapnia) e conseguente ipossiemia arteriosa secondo la formula: PaCO2 = produzione di CO2/Valv x K.
Diffusione e trasporto dei gas
- Il passaggio dei gas attraverso la membrana alveolo-capillare avviene mediante un processo passivo.
- Questo processo è condizionato da un gradiente di concentrazione per il quale le molecole di un determinato gas si spostano da zone ad alta concentrazione verso zone a concentrazione più bassa fino all’equilibrio. In una miscela gassosa la pressione di un determinato gas è detta pressione parziale ed è strettamente dipendente dalla temperatura e dal volume in cui il gas è contenuto. La diffusione attraverso i tessuti è descritta dalla legge di Fick che afferma che il flusso diffusionale di un gas. attraverso una lamina di tessuto è direttamente proporzionale all’area del tessuto e alla differenza di pressione parziale del gas tra i due lati, ed è inversamente proporzionale allo spessore del tessuto.
- La velocità di trasferimento di un gas attraverso la lamina di tessuto è in relazione:
- all’estensione della superficie di scambio;
- alla differenza della pressione parziale del gas ai due versanti della membrana;
- allo spessore della membrana;
- alle caratteristiche specifiche del tessuto e del gas (solubilità, peso molecolare), secondo la formula: V = ΔP x (A/d) X D dove V = volume di gas che attraversa la membrana, A = superficie di scambio, d = distanza di diffusione, spessore della membrana, D = coefficiente di diffusione del gas, ΔP = differenza di pressioni parziali del gas sui due versanti della membrana.
- La costante di diffusione è direttamente proporzionale alla solubilità del gas e inversamente proporzionale alla radice quadrata del suo peso molecolare, ciò sta a significare che la CO diffonde circa 20 volte più rapidamente dell’O2 perché ha una solubilità molto più alta pur avendo un peso molecolare simile a quello dell’O.
- Altro elemento importante è la distanza di diffusione: lo spessore della barriera alveolo-capillare va da 0,3 micrometri, dimensione ideale per la diffusione, fino a circa 4 micrometri. Un’irregolarità di spessore della membrana determinerà una disuniformità diffusoria.
- La diffusione dell’O2 è determinata da:
- capacità di fissazione massima da parte dell’Hb;
- resistenze eritrocitarie: possono incidere per un quarto rispetto alla resistenza totale alla diffusione;
- superficie di membrana: naturalmente ha l’ importanza solo quella superficie alveolo-capillare in cui il rapporto ventilazione/perfusione (V/Q) è normale;
- tempo di contatto aria/sangue (0,8 secondi). Durante l’esercizio intenso il flusso ematico polmonare aumenta considerevolmente e il tempo impiegato dal globulo rosso nel capillare si riduce, pertanto il tempo disponibili per l’ossigenazione è inferiore.
- Quindi la capacità di diffusione dipende da:
- un corretto rapporto V/Q;
- gradiente di pressione parziale dei gas (più alto è il gradiente, maggiore è la velocità di diffusione);
- peso molecolare del gas;
- solubilità fisica del gas nella membrana;
- spessore della membrana;
- estensione della superficie alveolo-capillare.
- La diffusione della CO2 è rallentata:
- per una minore differenza di pressione parziale ai due lati della membrana alveolo-capillare (P alv = 40 mmHg; P cap = 45 mmHg);
- per una maggiore complessità di reazione di liberazione della CO2 dal sangue all’alveolo, dove la CO2 arriva in parte legata all’Hb (carbamino-Hb) o sotto forma di bicarbonato per cui devono intervenire varie trasformazioni chimiche per attraversare la barriera alveolare. Nella pratica clinica la DL polmonare viene calcolata facendo inalare al soggetto una miscela con ossido di carbonio a bassissime concentrazioni ed elio a una concentrazione del 10%. L’ossido di carbonio è un gas estremamente diffusibile all’interno dei globuli rossi per cui la sua pressione all’interno del capillare polmonare può essere considerata uguale a zero: DLCO = VCO/P alv CO.
- Una volta avvenuta la diffusione, il sangue refluo dai polmoni entra nel circolo sistemico dove trasporta ossigeno ai tessuti e rimuove l’anidride carbonica, facendo da vettore ai gas e rendendo così possibile la respirazione interna, processo fondamentale che consente la vita e lo sviluppo di energia a livello cellulare. Se però l’ossigeno venisse trasportato nel sangue solo in forma fisicamente disciolta, esso sarebbe certamente insufficiente alle necessità cellulari: infatti la quantità trasportabile in tal modo è approssimativamente di 0,3 ml per 100 ml di sangue arterioso.
- L’ossigeno invece si lega in modo facilmente reversibile con l’emoglobina eritrocitaria formando ossiemoglobina (O2 +Hb – HbO2) che, proprio in virtù della reversibilità, permette all’O2 di essere rilasciato ai tessuti garantendone un apporto sufficiente, tanto che la quota trasportabile in questo modo è all’incirca 70 volte la quantità disciolta (20 ml per 100 ml di sangue arterioso).
- Sia la porzione in soluzione fisica, sia quella legata all’emoglobina, sono regolate dalla pressione parziale dell’O2 nel sangue (PaO2) e la relazione tra pressione parziale e saturazione emoglobinica in 02 è rappresentata dalla curva di dissociazione dell’ossiemoglobina (Immagine 04).
- Questa curva riflette l’affinità dell’Hb per l’O2 e quindi dal suo andamento dipende l’assunzione di ossigeno nei polmoni e la sua cessione alle cellule. Ha una forma sigmoidale e questo comporta come vantaggio che la PaO2 può diminuire da 100 mmHg fino a circa 60 mmHg senza avere una desaturazione ossiemoglobinica tale da provocare seri disturbi ipossici. Se la curva si sposta a destra vuol dire che si riduce l’affinità dell’emoglobina per l’O2 e aumenta la sua capacità di cederlo, quando si sposta a sinistra invece succede l’esatto contrario.
- L’aumento della PaCO2 della temperatura, della concentrazione del 2,3-difosfoglicerato nei globuli rossi e/o la riduzione del pH spostano la posizione della curva verso destra, mentre le condizioni opposte la spostano a sinistra. Si definisce Effetto Bohr proprio lo spostamento a destra della curva causato dalla liberazione di ioni idrogeno (riduzione del pH e aumento di CO2).
- Una misura utile per valutare la posizione della curva di dissociazione è la pO2 corrispondente a una saturazione di O2 del 50%, conosciuta come P50. Il suo valore normale è 27 mmHg nel sangue umano. Possiamo utilizzare tre punti sulla curva di dissociazione dell’emoglobina per ricordare come convertire la pO2 alla sua saturazione approssimativa.
- Questi sono:
- per il sangue arterioso normale pO2100: SO2 = 97%;
- per il sangue venoso misto normale pO240: SO2= 75%; P50 27: SO2 = 50%.
- La CO2 è trasportata nel sangue in tre forme: disciolta, come ione bicarbonato e legata alle proteine.
- La CO2 disciolta, obbedisce alla Legge di Henry come l’O2 ma è 20 volte più solubile di quest’ultima, questo comporta che circa il 10% del gas passa dal sangue al polmone in questa forma.
- La CO2 presente come ione bicarbonato, si forma per azione dell’enzima anidrasi carbonica secondo la seguente reazione H2O + CO2 = H2CO3 = H+ + HCO3–
- All’aumentare degli ioni H+ all’interno dei globuli rossi, HCO3– diffonde fuori dalla cellula, mentre gli H+ hanno più difficoltà nel farlo perchè la membrana cellulare è relativamente impermeabile ai cationi. Per mantenere la neutralità elettrica si avrà il cosiddetto “spostamento dei cloruri” (Ioni Cl– diffondono dal plasma nella cellula).
- Alcuni degli idrogenioni si legano all ‘Hb ridotta perché è meno acida, quindi è un migliore accettore di protoni rispetto alla forma ossigenata. La presenza di Hb ridotta nel sangue periferico determinerà così un trasporto di CO2 aumentato mentre l’ossigenazione nel capillare polmonare ne facilita la cessione (effetto Haldane).
- La restante parte di CO2 si combina con i gruppi NH2 delle proteine del sangue per formare i cosiddetti carbamino-composti. La proteina più importante è la globina dell’emoglobina.
- La curva di dissociazione della CO2 è molto più lineare e ripida della curva di dissociazione dell’ossigeno ed è influenzata dal livello di saturazione ossiemoglobinica: l’aumento della PaO2 sposta la curva a destra riducendo l’affinità dell’Hb per la CO2 con il suo conseguente rilascio.
Immagine 04
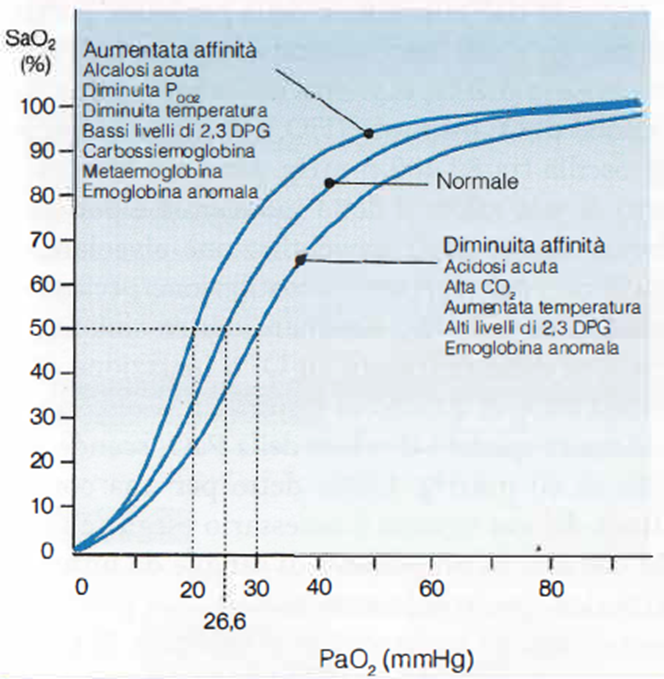
Immagine 04. Curva di dissociazione dell’Hb.
Equilibrio acido-base
Equilibrio acido-base
- L’organismo umano produce in continuazione addci (sostanze capaci di generare idrogenioni, H+) come risultato dei suoi metabolismi (protidico, glicidico e lipidico). Gli acidi prodotti, prima di raggiungere gli organi emuntori, passano nel sangue e questo passaggio deve avvenire senza modificazioni della normale concentrazione idrogenionica (40±4 nanoE-q/L). Variazioni di questi parametri possono alterare tutti i processi metabolici. La concentrazione di una soluzione viene espressa come pH: pH= -log10 [H+]
- Le fluttuazioni del pH sono mantenute in range limitati dai cosiddetti meccanismi di compenso o sistemi tampone, il più importante dei quali è il sistema bicarbonato/acido carbonico: CO2 + H2O <-> H2CO3 <-> H+ + HCO3–
- Allo scopo di mantenere un pH costante, il bilancio degli ioni H+ viene regolato dallo spostamento a sinistra o a destra della reazione. Questa funzione è svolta principalmente dal polmone e dal rene. Questi due sistemi sono definiti anche tamponi fisiologici e agiscono rispettivamente in modo rapido e lento. Il polmone esercita un potente controllo sull’equilibrio acido-base eliminando 10.000 mEq di acido carbonico al giorno. Rifacendoci all’equazione di Handerson-Hasselbach, che regola il pH ematico, possiamo capire quanto sia importante mantenere la PaCO2 in un range di normalità: pH = pK + log [H2CO3-]/PaCO2 x K
- La PaCO2 dipende, a sua volta, dalla quantità di CO2 prodotta e quindi dalla ventilazione alveolare secondo la formula: PaCO2 = (VCO2/Valv) x K dove VCO2 = produzione di CO2 in ml/min, Valv = ventilazione alveolare in 1/min, K = costante.
- È comprensibile che in caso di ipoventilazione alveolare la PaCO2 aumenta causando una riduzione del pH con conseguente acidosi respiratoria; viceversa avremo una condizione di alcalosi respiratoria in caso di iperventilazione.
- Il rene svolge un’azione più lenta, agendo dopo almeno 8-12 ore. La sua funzione cruciale è quella di recuperare i tamponi bicarbonato mediante il loro riassorbimento già nel tubulo prossimale o di generarli ex novo, oltre a quella di escretare ioni H+ sotto forma di ammoniaca: NH3 + H+ <-> NH4.
- Variazioni della concentrazione di questi ioni, determinano conseguenti variazioni del pH comportando situazioni cliniche particolari, che sono: acidosi e alcalosi respiratorie, metaboliche e miste che possono essere compensate o scompensate.
- L’esame utile a fornire informazioni sull’equilibro acido-base è l’emogasanalisi (EGA), che permette di misurare direttamente la PaO2, la PaCO2 e il pH ematico. L’EGA è l’indagine fondamentale per la diagnosi di insufficienza respiratoria, definita appunto dall’alterazione della pressione parziale dei gas, O2 e CO2, nel sangue arterioso. La PaO2 è una misura dell’O2 disciolto nel sangue a una data frazione di O2 inspirato (FiO2). Il range ai normalità oscilla tra 80-100 mmHg. Una riduzione al di sotto di tale valore è detta ipossiemia e può avere diverse cause, quali ipoventilazione alveolare, alterazione del rapporto ventilazione/perfusione, shunt intra o extra-polmonare destro-sinistro, alterazioni della diffusione di O2 o inalazione di O2 a bassa FiO2. Il quadro di insufficienza respiratoria si instaura quando il valore della PaO2 scende al di sotto di 60 mmHg. Come detto per una corretta lettura dei gas ematici è necessario eseguire l’EGA che consiste in un prelievo di sangue da un’arteria periferica, preferibilmente radiale, ma può anche essere eseguito su brachiale o femorale. Il sangue arterioso deve essere prelevato (2-3cc) da una siringa eparinata per evitare coaguli, prestando attenzione alla presenza di bolle d’aria che altererebbero il valore della PaO2.
- Con questa metodica possiamo misurare i seguenti parametri: pH arterioso, pressione parziale di O2 (PaO2), pressione parziale di CO2 (PaCO2), bicarbonati (HCO3-) e saturazione arteriosa di O2 (SaO2) (Tabella 01).
Tabella 01

Tabella 01. Principali disturbi respiratori dell’equilibrio acido-base.
Gas anionico
- Nella pratica clinica, i cationi misurati nel plasma sono generalmente il Na e il K, che rappresentano il 94% di quelli presenti nel LEC. Tra gli anioni, invece, l’84% è rappresentato dal Cl e i bicarbonati.
- La differenza tra la somma di tutti i cationi misurati (Na + K) e la somma degli anioni (Cl + bicarbonati) è definita gap anionico (Immagine 05). Questa differenza esprime la quota degli altri anioni (fosfati, solfati, acidi organici e proteine) ed è rappresentata dalla seguente formula matematica:
(Na + K) – (Cl+ HCO3)
(140 + 4) – (105 + 24) = 15 ± 3
- Il bicarbonato, con gli idrogenioni, svolge un ruolo ponte in questo equilibrio, perché oltre a essere un anione (carica negativa) è anche una base (accettore di idrogenioni). Sulla base della descritta relazione con la concentrazione di Cl, a una riduzione dei bicarbonati avremo un aumento di cloro e viceversa mantenendo normale il gap anionico (la loro somma rimane costante). Nel caso in cui sia i bicarbonati che il cloro siano diminuiti, il gap anionico aumenterà, rilevando un aumento patologico degli anioni che non vengono comunemente misurati. Questi anioni sono capaci di causare acidosi metabolica con due meccanismi, ossia la capacità intrinseca di indurre una diminuzione del pH per la propria acidità e di ridurre lo spazio ai bicarbonati in quanto anioni.
- In corso di acidosi respiratoria il gap anionico risulta generalmente normale grazie al compenso renale con assorbimento di bicarbonati ed escrezione di cloro, ma potrebbe variare se si associa acidosi lattica per la fatica muscolare e per l’ipossia periferica. Mentre in corso di acidosi metabolica a gap anionico elevato bisogna pensare alle cause di aumento degli anioni non misurati, es. chetoacidosi, uremia, salicilati, latticidemia, rambdiomiolisi, ecc.
Immagine 05
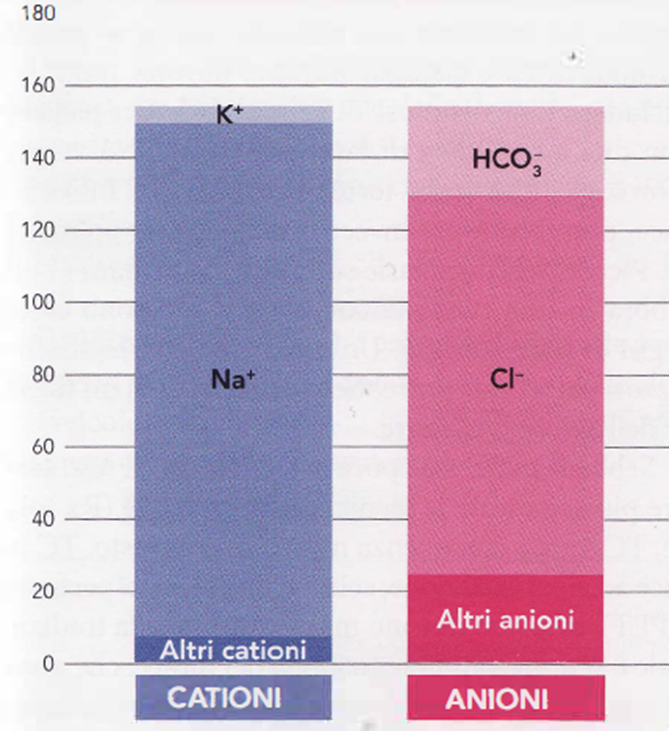
Immagine 05. GAP anionico.
Funzioni non respiratorie del polmone
- Il polmone svolge una serie di funzioni oltre alla principale propriamente respiratoria di scambio dei gas, quali:
- Difesa dalle polveri, dai pollini e dai diversi prodotti chimici presenti nell’aria inspirata (es. asbesto, silice); queste particelle vengono filtrate e rimosse dal trasporto mucociliare.
- Funzione di filtro, da parte del circolo polmonare, del circolo sistemico da sostanze estranee come per conseguenza di traumi o interventi terapeutici. Il materiale viene poi eliminato tramite lisi enzimatica o fagocitosi.
- Metabolismo di sostanze quali prostaglandine, angiotensina, serotonina e noradrenalina.
- Serbatoio di sangue tramite meccanismi di reclutamento e distensione capillare che permettono il mantenimento di basse pressioni.
- Difesa contro le infezioni grazie alla produzione di muco contenente prevalentemente IgA.