Dettagli
Ipocalcemia
I fattori che determinano la concentrazione sierica di calcio sono l’ormone paratiroideo (PTH), la vitamina D, lo stesso calcio ione e il fosfato.(30)
CAUSE
Basse concentrazioni di calcio sono dovute a disordini del PTH o della vitamina D. Altre cause di ipocalcemia includono i disordini che portano ad una diminuzione della concentrazione sierica del calcio ionizzato per un deposito nei tessuti, come avviene nell’iperfosfatemia nell’ambito della sindrome da lisi tumorale.(31)
Altre cause di ipocalcemia nel paziente oncologico sono le metastasi scheletriche, dissezione o irradiamento del testa-collo (con conseguente abbassamento del PTH secondario a disfunzione delle paratiroidi) e l’utilizzo di bifosfonati e Denosumab, che diminuiscono il riassorbimento osseo mediato dagli osteoclasti; in particolare l’ipocalcemia in concomitanza con l’utilizzo di bifosfonati e Denosumab è più frequente in pazienti con deficienza di vitamina D, ipoparatiroidismo e con insufficienza renale.(32)
Il deficit di calcio potrebbe inoltre essere mediato da alcuni agenti oncologici che spesso inibiscono il riassorbimento osseo osteoclastico: (33)
- alcuni farmaci implicati nell’ipocalcemia includono l’axitinib, il nab- paclitaxel (con un’ipocalcemia stimata di circa il 33%), l’estramustina (ipocalcemia stimata del 20%), alte dosi di interleukina-2, basse dosi di leucovorina/5-fluorouracile e l’octreotide (ipocalcemia stimata del 20%).(34)
- Trattamento delle lesioni ossee: oltre all’utilizzo dei bifosfonati e del Denosumab già citati, anche il Gallio 33 e lo Stronzio 89 possono generare fenomeni di ipocalcemia. Il Raloxifene, un modulatore selettivo del recettore degli estrogeni, riduce il riassorbimento osseo causando, in presenza di deficienza di Vitamina D, ipocalcemia. (35)
- Trattamento con anti-EGFR: l’utilizzo di cetuximab e panitunumab possono aumentare il rischio di ipocalcemia. (36)
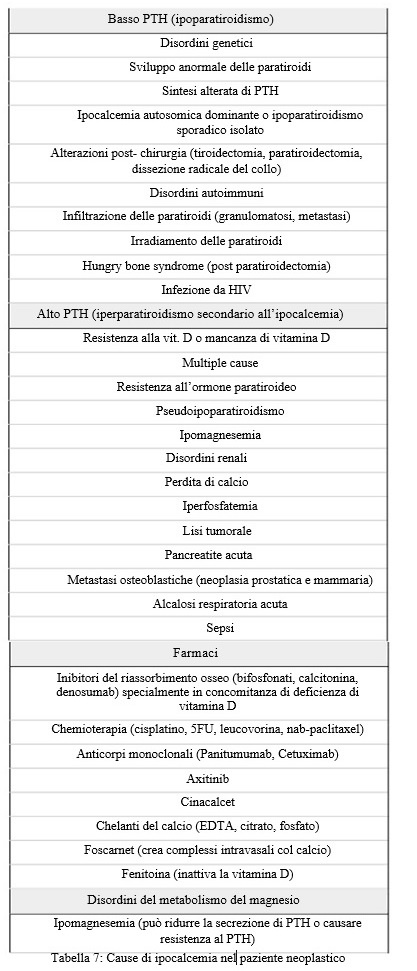
DIAGNOSI E MANIFESTAZIONI CLINICHE
Un uso consapevole di una breve serie di dati clinici e di laboratorio è sufficiente per stabilire la base eziologica dell’ipocalcemia nella maggior parte dei pazienti oncologici: tale comprensione è indispensabile per individuare un trattamento mirato (vedi figura 1 e tabella 9).
L’obiettività può inoltre rivelare segni di tetania latente, come i segni di Chvostek e Trousseau, che sono fortemente suggestivi di ipocalcemia.
L’ipocalcemia può essere associata ad un largo spettro di manifestazioni
cliniche, che vanno dall’assenza di
sintomi o paucisintomaticità nell’ipocalcemia lieve, a
sintomi che possono risultare fatali come crisi
epilettiche,
scompenso cardiaco o laringospasmo. Inoltre la velocità di sviluppo e la cronicità
ne determinano
la
sintomatologia.
Solitamente tetano, papilledema e crisi epilettiche insorgono in pazienti che sviluppano rapidamente l’ipocalcemia, mentre cataratta, calcificazione dei gangli della base e disordini extra- piramidali sono solitamente segni di un’ipocalcemia cronica.

Figura 1: approccio diagnostico al paziente con ipocalcemia
Ipocalcemia in pazienti sottoposti a terapie
inibenti l’attività osteoclastica
(bifosfonati e denosumab)
L’omeostasi delle calcemia è una delle più importanti funzioni dell’osso.(40) L’inibizione dell’attività osteoclastica può condurre allo sviluppo di ipocalcemia e ipofosfatemia, sebbene in molti pazienti l’instaurarsi di meccanismi di compenso, come l’aumentata secrezione di PTH, evitano tale quadro di alterazione elettrolitica. In alcuni casi i meccanismi compensatori non sono possibili (come per esempio per una precedente paratiroidectomia, bassi livelli di vitamina D, ipoparatiroidismo, insufficienza renale), creando così le basi per l’instaurarsi dell’ipocalcemia.(41)
In un report di 120 pazienti che avevano ricevuto acido zoledronico per mieloma multiplo o altre neoplasie maligne, l’ipocalcemia era stata osservata nel 35% dei pazienti. Un quadro di ipocalcemia severa che aveva reso necessaria l’infusione di calcio per via parenterale era stata osservata nell’8% dei pazienti, nonostante fosse stata effettuata una correzione del dosaggio di acido zoledronico basato sulla clearance della creatinina e fosse stata somministrata una supplementazione di calcio e vitamina D profilattica.(42)
Il Denosumab ha un’attività inibente il riassorbimento osseo più potente rispetto all’acido zoledronico, come dimostrato dai markers di turn over osseo (43),(44), per cui l’incidenza di ipocalcemia e ipofosfatemia è più elevata in pazienti che ricevono tale terapia rispetto a coloro che ricevono acido zoeldronico, come dimostrato nei tre studi registrativi.(45),(46),(43).
In un’analisi integrata di dati provenienti da tre studi, l’ipocalcemia di ogni grado era dimostrata essere del 9,6% nei pazienti trattati con denosumab versus il 5% dei pazienti trattati con acido zoledronico.(32)
Alterazioni dell’albuminemia. Le concentrazioni di sieriche di calcio sono normalmente mantenute entro un ristretto range che consente la normale attività extra ed intra-cellulare calcio-mediata. Il calcio è trasportato per un 45% in forma legata alle proteine plasmatiche, in parte agli anioni come il fosfato ed il citrato (15%) ed in parte come forma libera o ionizzata (40%).
Sebbene solo il calcio ionizzato sia metabolicamente attivo, molti laboratori riportano le concentrazioni di calcio totale. La normale calcemia generalmente va da 8,5 a 10,5 mg/dL (da 2.12 a 262 mmol/L): valori al di sotto di questo range sono da considerarsi come ipocalcemia. Il normale range di calcio ionizzato e 4,65 a 5,25 mg/dL (da 1,16 a 1,31 mmol/L).
Quando le concentrazioni proteiche sono alterate (in particolar modo l’albumina), la concentrazione di calcio totale può variare, mentre il calcio ionizzato, i cui livelli sono normalmente regolati dall’assetto ormonale, rimangono stabili. Per questa motivazione la concentrazione di calcio totale non riflette accuratamente la concentrazione del calcio ionizzato (o libero).
Per esempio, nelle malattie croniche, nell’ipervolemia o nel paziente malnutrito (in cui la concentrazione sierica di albumina è diminuita), il calcio plasmatico totale è basso, ma il calcio ionizzato è normale: questo fenomeno è noto come pseudoipocalcemia: la calcemia diminuisce approssimativamente di 0,8 mg/dl per ogni 1g/dL di abbassamento dell’albuminemia.
Per le motivazioni di cui sopra si raccomanda di correggere sempre i livelli sierici del calcio in funzione dell’albuminemia o in alternativa si può misurare il calcio ionizzato.
Alterazioni acido-base. Le alterazioni del Ph ematico possono alterare l’equilibrio del complesso albumina
– calcio (l’acidosi infatti ne riduce il legame). Pertanto in pazienti critici o nel periodo post-operatorio, correggere il calcio per i livelli sierici di albumina potrebbe non risultare accurato a causa dei cambiamenti del Ph. (47) In uno studio, per esempio, l’utilizzo della formula di correzione del calcio per l’albuminemia risultava sensibile solo nel 5% dei casi. Di conseguenza in presenza di alterazioni del Ph ematico, è prudente determinare i livelli di calcio ionizzato.
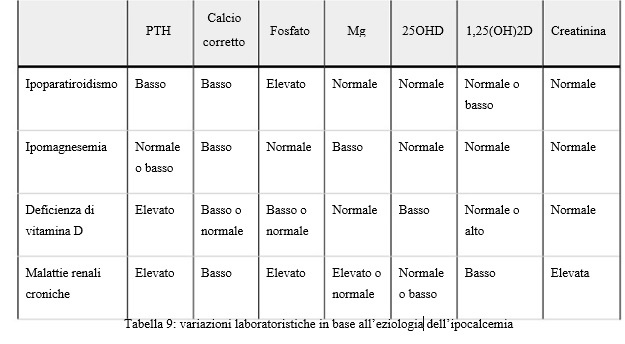
Concentrazioni di PTH sierico. Per la definizione dell’eziologia dell’ipocalcemia, la misurazione del PTH è il mezzo più valido ed andrebbe effettuata ed interpretata contemporaneamente alla misurazione del calcio in tutti i pazienti con tale deficit.
Le concentrazioni sieriche di PTH variano in base alla causa dell’ipocalcemia (vedi tabella 9). (48)
TRATTAMENTO
Raccomandazione 1: Gestione e prevenzione dell’ipocalcemia durante trattamento con farmaci inibenti l’attività osteoclastica. Valutazioni di vitamina D nel paziente oncologico hanno dimostrato un’elevata prevalenza di questa malattia carenziale (livelli inferiori a 30 ng/ml). (49) Quando ad un paziente con ipovitaminosi D viene somministrato un potente bifosfonato per via endovenosa o Denosumab, vi è
rischio di ipocalcemia anche severa e sintomatica, per cui è indispensabile una supplementazione di calcio e vitamina D. Sebbene oggi non vi siano elementi sufficienti per supportare in generale la supplementazione di
vitamina D in pazienti oncologici al di fuori di studi controllati,(50) sulla base dello sviluppo di iperparatiroidismo secondario ad ipocalcemia (che stimola l’attività osteoclastica limitando l’efficacia del farmaco e che potrebbe favorire la progressione di malattia), si raccomanda di effettuare in tutti i pazienti che debbano effettuare un trattamento con bifosfonati e Denosumab la supplementazione di calcio e vitamina D a dosi di almeno 1000 UI al giorno di vitamina D (colecalciferolo) e di 500 mg al giorno di calcio, possibilmente in formulazioni farmacologiche separate. (Livello di evidenza 3, grado di raccomandazione D).(51)
Raccomandazione 2: Gestione in acuto dell’ipocalcemia. Se i livelli sierici di calcio cadono al di sotto di 1,9 mmol/L, o i livelli di calcio ionizzato risultano essere inferiori a 1mmol/L, o in presenza di paziente sintomatico l’opzione di somministrare calcio per via endovenosa può essere presa in considerazione (Livello di evidenza 3; grado di raccomandazione D).(52)
La somministrazione di calcio gluconato dovrebbe avvenire attraverso un catetere venoso centrale al fine di evitare stravasi e conseguente irritazione dei tessuti circostanti.(53) Il calcio endovenoso viene solitamente somministrato in formulazioni da 10 ml di calcio gluconato al 10% diluito in 50-100 ml di destrosio 5%, infuso in 5- 10 minuti (Livello di evidenza 3; grado di raccomandazione D).(54)
Per evitarne la precipitazione, il calcio non dovrebbe essere infuso con fosfato e bicarbonato (Livello di evidenza 3; grado di raccomandazione D).(55)
Bisognerebbe inoltre somministrare una contemporanea supplementazione orale di calcio e calcitriolo (da 0,25 a 1 mcg/die). (Livello di evidenza 3; grado di raccomandazione D).
Inoltre andrebbero corrette eventuali anomalie sieriche concomitanti come l’ipomagnesemia o l’alcalosi. (61)
Una rapida correzione dell’ipocalcemia può contribuire allo sviluppo di aritmie cardiache, per cui durante
l’infusione di calcio gluconato per via parenterale, dovrebbe essere monitorizzata la funzione cardiaca, in
particolar modo in pazienti in trattamento digossinico. (56) (Livello di evidenza 3; grado di raccomandazione D).
Raccomandazione 3: trattamento dell’ipocalcemia cronica. In aggiunta alla correzione dell’ipomagnesiemia, la somministrazione di calcio e vitamina D per os è essenziale. (52) Il calcio carbonato
e il calcio citrato contengono il più alto rapporto di calcio essenziale (40 e 28% rispettivamente) e sono facilmente assorbiti; sono pertanto considerati i farmaci di scelta.(54) I dosaggi a cui tali formulazioni vengono somministrate sono solitamente 1 o 2 g di calcio essenziale tre volte al giorno (Livello di evidenza 3; grado di raccomandazione D). La supplementazione calcica e di calcitriolo solitamente normalizza
alterazioni elettrocardiografiche asintomatiche. (57) (livello di evidenza 2; grado di raccomandazione B).
Se l’ipocalcemia è dovuta al malassorbimento di vitamina D, andrebbe trattata la causa sottostante (per esempio l’incentivo di una dieta libera da glutine nel paziente celiaco). (58) La correzione del magnesio corregge l’ipocalcemia correlata a bassi livelli di magnesio.(59)
Raccomandazione 4: Insufficienza di Vitamina D. L’insufficienza di vitamina D richiede la correzione con ergocalciferolo (vitamina D2) o colecalciferolo (vitamina D3). L’ergocalciferolo può essere somministrato alla dose di 50 000 UI a settimana o due volte a settimana con un reassesment dei livelli di vitamina D a tre mesi, titolando finchè non si raggiungano normali livelli di 25(OH)D. (33) (livello di evidenza 1; grado di raccomandazione B). In alternativa si possono somministrare 300 000 UI di ergocalciferolo per via intramuscolare, con le prime due dosi a distanza di tre mesi e le successive ogni sei mesi. (60) (Livello di evidenza 3; grado di raccomandazione D).
Il colecalciferolo è più potente dell’ergocalciferolo; la somministrazione di 100 000 UI di vitamina D3 una volta ogni 3 mesi è efficace nel mantenere un adeguato livello di 25(OH) D.(54) (livello di evidenza 1; grado di raccomandazione B).
Raccomandazione 5: ipoparatiroidismo. Il trattamento dell’ipoparatiroidismo richiede una valutazione globale del paziente ed un’attenta valutazione delle opzioni terapeutiche oltre alla correzione dell’ipocalcemia. Lo scopo primario della correzione con calcio e vitamina D è il controllo dei sintomi, il mantenimento dei livelli di calcemia entro un range tra 2,00 e 2,12 mmol/L e l’ottenimento di un rapporto calcio – fosfato al di sotto di 4,4 mmol/L2 senza lo sviluppo di ipercaliuria e la precipitazione di sali di calcio nei tessuti molli (Livello di evidenza 3; grado di raccomandazione D).(61)
Solitamente viene utilizzato un analogo della vitamina D come il calcitriolo alla dose di 0,5 mcg/die con un aumento di dose ogni 4 – 7 giorni sino al raggiungimento di livelli di calcemia medio- bassi. (62) (Livello di evidenza 3; grado di raccomandazione D).
I diuretici tiazidici diminuiscono l’escrezione urinaria di calcio grazie all’incrementato riassorbimento tubulare distale: si può quindi considerare la somministrazione di tali farmaci unitamente a una dieta a basso contenuto di fosfati. (52) Livello di evidenza 3; grado di raccomandazione D).
La misurazione della calcemia, della concentrazione di fosforo e della creatinina dovrebbe essere eseguita ogni settimana durante le somministrazioni iniziali per poi passare a ogni quattro mesi alla stabilizzazione della dose.(63) (Livello di evidenza 3; grado di raccomandazione D).
Bibliografia
1. Stewart AF. Clinical practice. Hypercalcemia associated with cancer. N Engl J Med 2005.
2. Waller A, Caroline NL. Hypercalcemia. Handbook of Palliative Care in Cancer. 2nd ed. Boston, MA: Butterworth- Heinemann; 2000. p. 367-72.
3. Dean M, Harris JD, Regnard C, Hockley J. Emergencies. Symptom Relief in Palliative Care. Oxford, United Kingdom: Radcliffe Publishing; 2006. p. 201-19.
4. Vincenzi B, Santini D. et al. Zoledronic acid delays the onset of skeletal-related events and progression of skeletal disease in patients with advanced renal cell carcinoma. Cancer. 2004.
5. Keiko A, et al. Hypercalcemia in Upper Urinary Tract Urothelial Carcinoma: A Case Report and Literature Review. Case Rep Endocrinol. 2013.
6. Agarwall KK. et al. Ovarian carcinoma producing parathyroid hormone-related protein causing hypercalcemia and metastatic calcification detected on 18 F-FDG PET-CT. Indian J Nucl Med. 2013.
7. Bower M, Cox S. Endocrine and metabolic complications of advanced cancer. In: Doyle D, Hanks G, Cherny NI, Calman K, editors. Oxford Textbook of Palliative Medicine. 3rd ed. Oxford, England: Oxford University Press; 2004, paperback 2005. p. 687-702.
8. Morton AR, Lipton A. Hypercalcemia. In: Abeloff MD, Armitage JO, Niederhuber JE, Kastan MB, McKenna WG, editors. Abeloff’s clinical oncology, 4th edition. Philadelphia, PA: Churchill Livingstone; 2008. 9. Society for Endocrinology. Acute hypercalcemia. Emergency Endocrine Guidance. 2013.
10. PDQ Supportive and Palliative Care Editorial Board. Hypercalcemia PDQ. 2013.
11. Capital Health Regional Palliative Care Program. Hypercalcemia of Malignancy. 2005 March 17, 2005. http://www.palliative.org/PC/ClinicalInfo/Clinical%20Practice%20Guidelines/PDF%20files/3A5%20Hypercalcemia%20of%20Malignancy.pdf.
12. Pi J, Kang Y, Smith M, et al: A review in the treatment of oncologic emergencies J Oncol Pharm Pract 1078155215605661,2015.
13. Fraserhealth Hospice Palliative Care Program. Hypercalcemia in Malignant Disease. 2004 November 24. 2004.
14. Hagerty D R. Evidence-Based Treatment of Hypercalcemia. Medescape. 2009.
15. Hosking DJ. et al. Rehydration in the treatment of severe hypercalcaemia. Q J Med. 1981.
16. LeGrand SB, Leskuski D, Zama I: Narrative review: Furosemide for hypercalcemia: An unproven yet common practice Ann Intern Med 149:259-263,2008.
17. Lorraine I. et al. Corticosteroids in the Treatment of Neoplasms. Cancer Med. 2003.
18. Austin LA. Et al. Calcitonin: physiology and pathophysiology. N Engl J Med. 1981.
19. Chevallier B. et al, Human calcitonin in neoplastic hypercalcemia. Results of a prospective randomized trial. Presse Med. 1988.
20. Santini D. et al. The antineoplastic role of bisphosphonates: from basic research to clinical evidence. Ann Oncol. 2003.
21. Berenson JR. Treatment of hypercalcemia of malignancy with bisphosphonates. Semin Oncol. 2002.
22. Major P, et al. Zoledronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: a pooled analysis of two randomized, controlled clinical trials. J Clin Oncol. 2001.
23. Vincenzi B. et al. Serum VEGF levels as predictive marker of bisphosphonate-related osteonecrosis of the jaw. J Hematol Oncol. 2012.
24. Massagli TL, Cardenas DD. Immobilization hypercalcemia treatment with pamidronate disodium after spinal cord injury. Arch Phys Med Rehabil. 1999.
25. Walls J. et al. Response to intravenous bisphosphonate therapy in hypercalcaemic patients with and without bone metastases: the role of parathyroid hormone-related protein. Br J Cancer. 1994.
26. Schwartz LM, Woloshin S. Lost in transmission–FDA drug information that never reaches clinicians. N Engl J Med. 2009.
27. Diel IJ, Body JJ, Stopeck AT, et al: The role of denosumab in the prevention of hypercalcaemia of malignancy in cancer patients with metastatic bone disease Eur J Cancer 51:1467-1475,2015.
28. Salahudeen AA, Gupta A, Jones JC, et al: PTHrP-induced refractory malignant hypercalcemia in a patient with chronic lymphocytic leukemia responding to denosumab Clin Lymphoma Myeloma Leuk 15:e137-
e140,2015.
29. Mimi I-Nan Hu et al. Denosumab for the treatment of bisphosphonate-refractory hypercalcemia of malignancy (HCM). J Clin Oncol. 2013.
30. Riccardi D, Brown EM. Physiology and pathophysiology of the calcium-sensing receptor in the kidney. Am J Physiol Renal Physiol. 2010.
31. Thakker RV. Hypocalcemia: Pathogenesis, differential diagnosis, and management. In: Primer on the metabolic bone diseases and disorders of mineral metabolism, sixth edition, American Society of Bone and Mineral Research 2006.
32. Lipton A, Fizazi K, Stopeck AT, Henry DH, Brown JE, Yardley DA, Richardson GE, Siena S, Maroto P, Clemens M, Bilynskyy B, Charu V, Beuzeboc P, Rader M, Viniegra M, Saad F, Ke C, Braun A, Jun S. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer. 2012.
33. Liamis G, Milionis HJ, Elisaf M. A review of drug-induced hypocalcemia. J Bone Miner Metab. 2009;27:635-42.
34. van Vliet EI, de Herder WW, de Rijke YB, et al. Hypocalcemia after treatment with [177Lu-DOTA0,Tyr3]octreotate. Eur J Nucl Med Mol Imaging. 2013;40:1843-52.
35. Vu TD, Varadarajan S, Seeman E, et al. Hypocalcemia induced by raloxifene. Curr Drug Saf. 2012;7:176-8.
36. Qiaoli Wang, Yuexiao Qi, Di Zhang, Caifeng Gong, Anqi Yao, Yi Xiao, Jie Yang, Fuxiang Zhou, Yunfeng Zhou. Electrolyte disorders assessment in solid tumor patients treated with anti-EGFR monoclonal antibodies: a pooled analysis of 25 randomized clinical trials. Tumour Biol. 2015 May; 36(5): 3471-3482.
37. Tohme JF, Bilezikian JP. Hypocalcemic emergencies. Endocrinol Metab Clin North Am. 1993.
38. Endocrinol Metab Clin North Am. 1993. Reversible parkinsonism and asymptomatic hypocalcemia with basal ganglia calcification from hypoparathyroidism 26 years after thyroid surgery. Am J Med. 1993.
39. Stein R, Godel V. Hypocalcemic cataract. J Pediatr Ophthalmol Strabismus. 1980.
40. Blair HC, Robinson LJ, Huang CL, Sun L, Friedman PA, Schlesinger PH, Zaidi M. Calcium and bone disease. Biofactors. 2011.
41. Dunstan CR, Felsenberg D, Seibel MJ. Therapy insight: the risks and benefits of bisphosphonates for the treatment of tumor-induced bone disease. Nat Clin Pract Oncol. 2007.
42. Chennuru S, Koduri J, Baumann MA. Risk factors for symptomatic hypocalcaemia complicating treatment with zoledronic acid. Intern Med J. 2008.
43. Fizazi K, Carducci M, Smith M, Damião R, Brown J, Karsh L, Milecki P, Shore N, Rader M, Wang H, Jiang Q, Tadros S, Dansey R, Goessl C. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet. 2011.
44. Santini D, Schiavon G, Vincenzi B, Gaeta L, Pantano F, Russo A, Ortega C, Porta C, Galluzzo S, Armento G,La Verde N, Caroti C, Treilleux I, Ruggiero A, Perrone G, Addeo R, Clezardin P, Muda AO, Tonini G. Receptor activator of NF-kB (RANK) expression in primary tumors associates with bone metastasis occurrence in breast cancer patients. PLoS One. 2011.
45. Stopeck AT, Lipton A, Body JJ, Steger GG, Tonkin K, de Boer RH, Lichinitser M, Fujiwara Y, Yardley DA, Viniegra M, Fan M, Jiang Q, Dansey R, Jun S, Braun A. Denosumab compared with zoledronic acid for the
treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J
Clin Oncol. 2010.
46. Henry DH, Costa L, Goldwasser F, Hirsh V, Hungria V, Prausova J, Scagliotti GV, Sleeboom H, Spencer A, Vadhan-Raj S, von Moos R, Willenbacher W, Woll PJ, Wang J, Jiang Q, Jun S, Dansey R, Yeh H.
Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in
patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol.
2011.
47. Dickerson RN, Alexander KH, Minard G, Croce MA, Brown RO. Accuracy of methods to estimate ionized and “corrected” serum calcium concentrations in critically ill multiple trauma patients receiving specialized nutrition support. JPEN J Parenter Enteral Nutr. 2004.
48. Haden ST, Brown EM, Hurwitz S, et al. The effects of age and gender on parathyroid hormone dynamics. Clin Endocrinol. 2000.
49. HolicK MF. Vitamin D deficiency. N Engl J Med, 2007.
50. Buttigliero C. et al. Prognostic role of vitamin D status and efficacy of vitamin D supplementation in cancer patients: a systematic review. Oncologist, 2011.
51. Linee guida AIOM 2013.
52. Cooper MS, Gittoes NJ. Diagnosis and management of hypocalcaemia. BMJ. 2008.
53. Shoback D. Clinical practice. Hypoparathyroidism. N Engl J Med. 2008.
54. Murphy E, Williams GR. Hypocalcaemia. Medicine. 2009.
55. Tohme JF, Bilezikian JP. Diagnosis and treatment of hypocalcemic emergencies. Endocrinologist. 1996.
56. Maeda SS, Fortes EM, Oliveira UM, Borba VC, Lazaretti-Castro M. Hypoparathyroidism and pseudohypoparathyroidism. Arq Bras Endocrinol Metabol. 2006.
57. Walker Harris V, Jan De Beur S. Postoperative hypoparathyroidism: medical and surgical therapeutic options. Thyroid. 2009.
58. . Effects of calcium treatment on QT interval and QT dispersion in hypocalcemia. Am J Cardiol. 2003.
59. Hopper AD, Hadjivassiliou M, Butt S, Sanders DS. Adult coeliac disease. BMJ. 2007.
60. Tangpricha V, Koutkia P, Rieke SM, Chen TC, Perez AA, Holick MF. Fortification of orange juice with vitamin D: a novel approach for enhancing vitamin D nutritional health. Am J Clin Nutr. 2003.
61. Trivedi DP, Doll R, Khaw KT. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial.
BMJ. 2003.
62. Noordzij M, Voormolen NM, Boeschoten EW, Dekker FW, Bos WJ, Krediet RT, et al. Disordered mineral metabolism is not a risk factor for loss of residual renal function in dialysis patients. Nephrol Dial Transplant.
2009.
63. Walker Harris V, Jan De Beur S. Postoperative hypoparathyroidism: medical and surgical therapeutic options.
Thyroid. 2009.