Dettagli
- Definizione
- Epidemiologia
- Eziologia e patogenesi
- Anamnesi ed esame obiettivo
- Diagnosi
- Terapia
- Immagine 01
- Immagine 02
- Immagine 03
- Immagine 04
Malattia di Cushing
Definizione
- La malattia di Cushing (o sindrome di Cushing ipofisaria) è un ipercortisolismo causato da un tumore dell’ipofisi (solitamente un microadenoma) secernente l’ormone adrenocorticotropo ACTH. Un eccesso di ACTH iperstimola le ghiandole surrenali, provocando una sovrapproduzione di cortisolo e questo, insieme alla perdita della fisiologica variazione diurna, causa i sintomi e i segni variabili della sindrome di Cushing.
- La malattia di Cushing causa circa il 70% delle sindromi endogene. Altri nomi del disturbo incudono: ipofisi di Cushing, corticotropinoma (adenoma secernente ormone adrenocorticotropo ACTH) ed iperfunzione adrenocorticale secondaria. Essa deriva da un’esposizione inappropriata e prolungata a concentrazioni eccessive di cortisolo libero.
- L’ ipercortisolismo fisiologico o stato di pseudo-Cushing si riferisce alla condizione in cui i pazienti possono mostrare alcune caratteristiche cliniche e paracliniche della sindrome, ma non presentano tumori o cause patologiche sottostanti. Il disturbo è comune nell’alcolismo e nell’insufficienza renale cronica, nell’obesità grave ed in alcune condizioni psichiatriche.
- Un microadenoma è definito tale se sotto i 10 mm di diametro, mentre sopra prende il nome di macroadenoma.
Epidemiologia
- La patologia colpisce prevalentemente le donne in età riproduttiva; il rapporto femmine-maschi riportato è di 3-5. Nei bambini uno studio del 2004 ha evidenziato una prevalenza maschile in pazienti prepuberi.
Eziologia e patogenesi
- La principale causa è la sovrasecrezione patologica dell’ormone adrenocorticotrofico (ACTH) da parte degli adenomi ipofisari che si traduce in un disturbo del normale meccanismo di feedback del cortisolo all’interno dell’asse ipotalamo-ipofisi-surrene, con conseguente interruzione del ritmo circadiano della produzione di cortisolo ed eccesso di secrezione dell’ormone. I tumori ipofisari secernenti ACTH (tumori corticotrofi) sono caratterizzati dall’espressione aberrante di proteine coinvolte nella regolazione del ciclo cellulare, proliferazione, crescita e differenziazione. In condizioni normali, i fattori ipotalamici stimolatori e inibitori e il ciclo di feedback negativo della secrezione di glucocorticoidi dalle ghiandole surrenali mantengono l’omeostasi corticotrofica fisiologica. L’ormone di rilascio della corticotropina (CRH) e la vasopressina innescano la sintesi dell’ACTH attraverso i loro recettori accoppiati alla proteina G-stimolatoria (GPCR). La resistenza parziale al feedback negativo dei glucocorticoidi nei tumori corticotrofi contribuisce all’ipersecrezione di ACTH; per questa resistenza sono stati proposti diversi meccanismi come: mutazioni nel gene del recettore nucleare sottofamiglia 3 gruppo C membro 1 (NR3C1) che codifica il recettore dei glucocorticoidi, alti livelli di 11-beta-idrossisteroide deidrogenasi isoforma che inattiva il cortisolo, diminuzione dell’espressione di 2 coregolatori trascrizionali, Brahma-related gene 1 (BRG1) e istone deacetilasi 1 (HDAC1), sovraespressione del repressore dei glucocorticoidi, recettore testicolare 4 (recettore nucleare sottofamiglia 2 [NRF2], gruppo C, membro 2) e sovraespressione della proteina 90 dello shock termico (HSP90) che compromette la capacità dei glucocorticoidi di reprimere la trascrizione della proopiomelanocortina (POMC).
- La mutazione nella proteasi ubiquitina-specifica 8 (USP8) è riportata nel 35%-60% dei pazienti con malattia di Cushing. L’USP8 è un enzima deubiquitinante che svolge un ruolo importante nella regolazione del recettore del fattore di crescita epidermico (EGFR). Al legame con il ligando dunque, l’EGFR è ubiquitinato e destinato alla degradazione; l’USP8 a sua volta deubiquitina EGFR, proteggendolo dalla degradazione e riciclandolo alla membrana cellulare dove può trasdurre la sua attività stimolatoria sulla sintesi dell’ACTH. Infine, le proteine 14-3-3 regolano normalmente l’attività di USP8 e di questa deubiquitinazione, impedendo la sua piena attivazione. Nelle cellule mutate USP-8, il legame tra USP8 e 14-3-3 è bloccato, permettendo a questo USP8 mutato di deubiquitinare efficacemente l’EGFR, potenziando la sua segnalazione e stimolando la sintesi e la secrezione di ACTH.
Anamnesi ed esame obiettivo
- La presentazione clinica della malattia di Cushing è molto varia e i pazienti possono presentare: obesità localizzata nel tronco, faccia arrotondata (“moon facies”), cuscinetti di grasso sopraclavicolare e/o dorsocervicale (“gobba di bufalo”), manifestazioni cardiovascolari (ipertensione, trombosi venosa profonda, embolia polmonare ed aumento del rischio di ictus/infarto del miocardio). Le manifestazioni della pelle e dei capelli possono includere: irsutismo, ematomi che compaiono facilmente, alopecia, pletora facciale, acne, strie rubrae/violacee sull’addome e sulle ascelle (“segno della lira”), lenta guarigione della ferite ed assottigliamento della pelle. I sintomi metabolici possono invece includere iperglicemia ed iperlipidemia. La disfunzione sessuale può essere accompagnata da una diminuzione della libido, disfunzione erettile, amenorrea secondaria ed infertilità. La crescita lineare è ridotta nei bambini e possono apparire sintomi neuropsichiatrici quali: disfunzione cognitiva, insonnia, ansia, irritabilità, depressione, mania, psicosi, fatica, senso di inferiorità e qualità di vita ridotta. Inoltre può associarsi un aumento del rischio di infezioni/sepsi, miopatia, specialmente prossimale, osteoporosi, steatosi epatica e nefrolitiasi.
Diagnosi
- La diagnosi viene basata sulle caratteristiche tipiche dell’ipercortisolismo e richiede la dimostrazione della causa ipofisaria dipendente dall’ormone adrenocorticotropo (ACTH). Livelli elevati di cortisolo sierico, cortisolo urinario e/o cortisolo salivare confermano l’ipercortisolismo. Un elevato livello sierico di ACTH conferma l’ipercortisolismo ACTH-dipendente. Test aggiuntivi vengono utilizzati per differenziare la fonte ipofisaria da quella ectopica. In seguito, una volta che l’ipercortisolismo ACTH-dipendente è confermato, la diagnosi di malattia di Cushing si basa tipicamente su 1 dei seguenti tra:
- risonanza magnetica pituitaria che mostra una lesione isolata di ≥ 6 mm;
- campionamento bilaterale del seno petroso inferiore;
- risposta alla soppressione del desametasone ad alte dosi e/o al test dell’ormone di rilascio della corticotropina (CRH).
- La diagnosi differenziale si pone con: stato di pseudo-Cushing, uso di glucocorticoidi esogeni, sindrome da ormone di rilascio della corticotropina (CRH) ectopica, adenoma corticale surrenale, carcinoma corticale surrenale, iperplasia surrenalica macronodulare indipendente dalla corticotropina, malattia surrenale nodulare pigmentata primaria, complesso di Carney e sindrome di McCune-Albright.
- Come approccio iniziale per diagnosticare l’ipercortisolemia nessun singolo test risulta avere un’alta specificità, quindi sono necessari ≥ 2 risultati screening anormali per diagnosticare la sindrome di Cushing. E’ possibile considerare l’uso di glucocorticoidi esogeni ed i test di prima scelta possono includere:
- cortisolo libero urinario (cortisolo libero nelle 24 ore con creatinina delle 24 ore e volume per valutare la completezza della raccolta, ≥ 2 misurazioni);
- livelli di cortisolo salivare notturno (≥ 2 misurazioni);
- test di soppressione del desametasone a basso dosaggio (LDDST): 1 mg durante la notte o 2 mg al giorno per 48 ore.
- Altre opzioni di test di seconda linea che possono essere utili nei pazienti con risultati equivoci per il cortisolo libero nelle urine includono il dexametasone-ormone di rilascio della corticotropina (test Dex-CRH) ed i livelli sierici di cortisolo a mezzanotte.
- Se i risultati iniziali sono normali, una valutazione dell’endocrinologo è raccomandata per i pazienti con alta probabilità di sindrome di Cushing. Una rivalutazione è suggerita in 6 mesi se i segni o i sintomi progrediscono.
- Se ≥ 1 risultato anormale, una valutazione dell’endocrinologo è raccomandata se si sospetta un falso positivo o nel costante sospetto di sindrome di Cushing. E’ possibile anche considerare una diagnosi differenziale con lo stato di pseudo-Cushing.
- Altre condizioni che possono anche avere alcune caratteristiche cliniche della sindrome includono: gravidanza, depressione, dipendenza dall’alcol, resistenza ai glucocorticoidi, obesità morbosa e diabete mellito mal controllato.
- Condizioni raramente compatibili con la sindrome di Cushing includono: stress fisico, malnutrizione, anoressia nervosa, esercizio cronico intenso, amenorrea ipotalamica ed eccesso di cortisolo-binding globulin (CBG) (cortisolo sierico aumentato ma cortisolo urinario normale o basso).
- Per confermare la diagnosi di ipercortisolismo, ripetere il dosaggio o eseguire 1 o 2 test alternativi. Quest’ultimi non sono raccomandati in caso di 2 test con risultati concordanti negativi, a meno che non si sospetti una malattia di Cushing ciclica (rara). Test aggiuntivi per determinare la causa della sindrome sono raccomandati nei pazienti per i quali i test iniziali con ≥ 2 modalità diverse indicano la presenza di ipercortisolismo e per i quali non si sospetta un’eziologia diversa. Il test della desmopressina non è raccomandato, se non negli studi di ricerca. Tutti i test vanno eseguiti in assenza di una malattia acuta concomitante (come un’infezione) per massimizzare la specificità e minimizzare i falsi positivi. Ulteriori test per valutare la malattia di Cushing includono misurare il livello di ormone adrenocorticotropo (ACTH) nel siero:
- ACTH > 4,4 pmol/L (> 20 pg/mL) è coerente con la sindrome di Cushing ACTH-dipendente;
- ACTH < 1,1 pmol/L (< 5 pg/mL) è coerente con la sindrome di Cushing indipendente dall’ACTH;
- se l’ACTH è ripetutamente equivoco (5-20 pg/ml), considerare il test di stimolazione Dex-CRH o il test di stimolazione della desmopressina.
- Per la sindrome di Cushing ACTH-dipendente confermata, la risonanza magnetica è la procedura di scelta per il rilevamento di un adenoma pituitario. La presenza di un tumore ipofisario > 6 mm può aiutare a differenziare la malattia di Cushing dalla secrezione ectopica di ACTH. Inoltre possiamo ritrovare:
- test di soppressione del desametasone ad alte dosi (HDDST);
- campionamento bilaterale del seno petroso inferiore (BIPSS, invasivo ma considerato standard di riferimento);
- test di stimolazione del CRH (in genere fatto se altri test non sono conclusivi).
- Una valutazione per identificare i fattori di rischio per la trombosi venosa è suggerita in tutti i pazienti con sindrome di Cushing.
Terapia
- La resezione chirurgica completa del tumore primario è raccomandata come trattamento di prima linea, a meno che questa non sia fattibile o sia sconsigliato ridurre significativamente l’eccesso di glucocorticoidi. In questo caso, un’adenomectomia selettiva transfenoidale da parte di un chirurgo esperto è raccomandata come trattamento ottimale sia nei bambini che negli adulti. Un follow-up individualizzato è suggerito in base al fatto che i livelli di cortisolo nel siero post-operatorio possano indicare ipo-, iper- o eucortisolismo. Nei pazienti con malattia di Cushing ricorrente, si raccomanda di ripetere la chirurgia transfenoidale, in particolare nei pazienti con resezione iniziale incompleta o lesione recidivante. La chirurgia transfenoidale endoscopica può essere più efficace per rimuovere i tumori primari e ricorrenti rispetto alla chirurgia transfenoidale microscopica, avendo meno effetti collaterali.
- La radioterapia o la radiochirurgia sono suggerite per il fallimento dell’adenomectomia selettiva transfenoidale o per la malattia di Cushing ricorrente. La radioterapia è raccomandata se ci sono preoccupazioni per gli effetti sulla massa o sull’invasione associata agli adenomi corticotrofici. E’ raccomandato assicurarsi che la terapia medica sia efficace per normalizzare i livelli di cortisolo prima di iniziare la radioterapia o la radiochirurgia, perché sarà necessario un tempo di attesa dell’effetto delle radiazioni.
- La terapia medica può avere un ruolo primario o addizionale nel trattamento della malattia di Cushing se il paziente non può sottoporsi in sicurezza alla chirurgia, se la chirurgia fallisce o se il tumore si ripresenta. Gli inibitori della steroidogenesi vengono raccomandati come trattamento di seconda linea dopo l’adenomectomia selettiva transfenoidale (con o senza radioterapia/radiochirurgia). I trattamenti medici diretti all’ipofisi sono suggeriti nei pazienti che non sono candidati alla chirurgia o che hanno una malattia persistente dopo l’adenomectomia selettiva transfenoidale. Gli antagonisti dei glucocorticoidi sono suggeriti per i pazienti con diabete o intolleranza al glucosio che non sono candidati alla chirurgia o che hanno una malattia persistente dopo l’adenomectomia selettiva transfenoidale. La terapia medica può indurre la normalizzazione del cortisolo nei pazienti con malattia di Cushing, ma è associata a gravi effetti collaterali nel 15,2% dei pazienti.
- L’adrenalectomia bilaterale viene suggerita come trattamento d’emergenza salvavita per la malattia molto grave ACTH-dipendente se un controllo rapido non viene raggiunto con la terapia medica.
- Il follow-up a lungo termine dovrebbe includere il trattamento delle comorbidità specifiche associate alla sindrome di Cushing (come i fattori di rischio cardiovascolare, l’osteoporosi, i sintomi psichiatrici e il rischio di tromboembolia venosa) fino alla risoluzione, e lo screening immagistico va effettuato per tutta la vita come prevenzione per le recidive.
Immagine 01
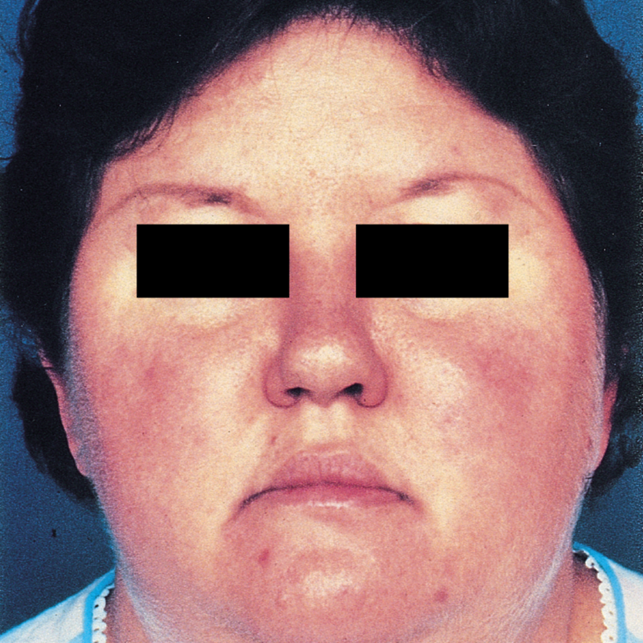
Immagine 01. Facies caratteristica nella malattia di Cushing.
Immagine 02
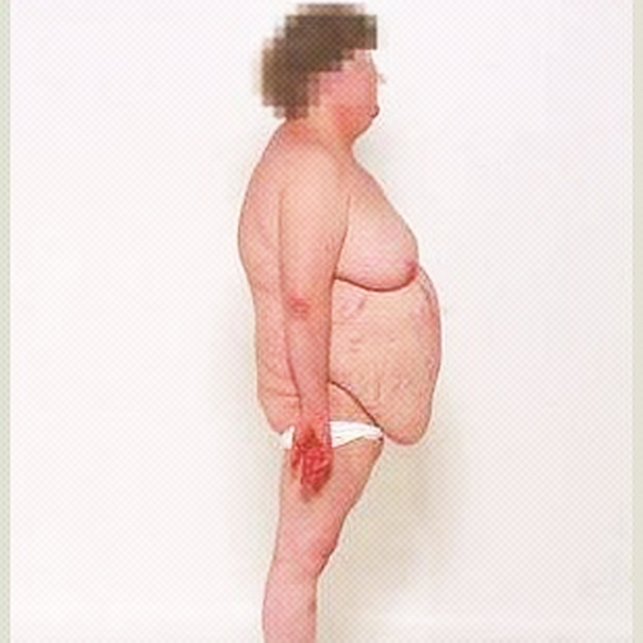
Immagine 02. Conformazione corporea con addome pendulo e gibbo di bufalo.
Immagine 03
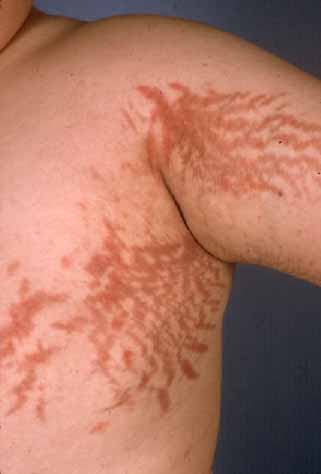
Immagine 03. Smagliature cutanee su braccia e torace nella sindrome di Cushing.
Immagine 04
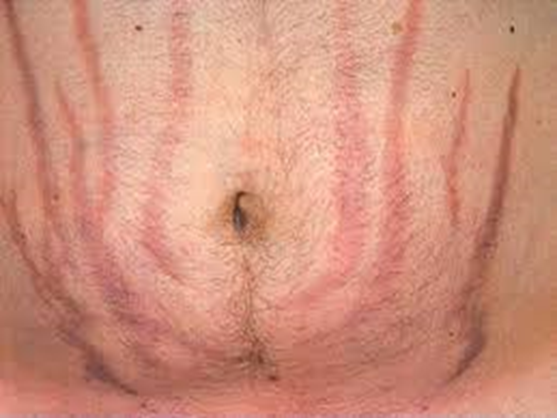
Immagine 04. Smagliature rosse dell’addome.