Dettagli
Legionella
1.1. Introduzione
Le legionelle sono presenti negli ambienti acquatici naturali e artificiali: acque sorgive, comprese quelle termali, fiumi, laghi, fanghi, ecc. Da questi ambienti esse raggiungono quelli artificiali come condotte cittadine e impianti idrici degli edifici, quali serbatoi, tubature, fontane e piscine, che possono agire come amplificatori e disseminatori del microrganismo, creando una potenziale situazione di rischio per la salute umana (Declerck et al., 2007; Fliermans et al., 1981).
“Legionellosi” è la definizione di tutte le forme morbose causate da batteri Gram-negativi aerobi del genere Legionella. Essa si può manifestare sia in forma di polmonite con tasso di mortalità variabile tra 10-15%, sia in forma febbrile extrapolmonare o in forma subclinica. La specie più frequentemente coinvolta in casi umani è L. pneumophila anche se altre specie sono state isolate da pazienti con polmonite (Allegato 1). Nel presente documento, i termini “legionellosi” e “Malattia dei Legionari”, vengono usati come sinonimo per indicare le forme morbose gravi (polmoniti) causate da microrganismi del genere Legionella.
Dopo la prima identificazione nel 1976 (Fraser et al., 1977; McDade et al., 1979), si è osservato un po‟ ovunque nei Paesi industrializzati un notevole incremento del numero di casi e questo può essere attribuito sia al miglioramento degli strumenti diagnostici disponibili e alla maggiore sensibilità dei clinici nei confronti della malattia, sia all‟aumento delle occasioni di esposizione all‟agente eziologico dovuto all‟incremento del turismo, della frequentazione di centri-benessere e alla sempre più diffusa installazione di impianti di condizionamento centralizzati negli ambienti ad uso collettivo, dotati di torri di raffreddamento e/o condensatori evaporativi.
Essendo il microrganismo ubiquitario, la malattia può manifestarsi con epidemie dovute ad un‟unica fonte con limitata esposizione nel tempo e nello spazio all‟agente eziologico, oppure con una serie di casi indipendenti in un‟area ad alta endemia o con casi sporadici senza un evidente raggruppamento temporale o geografico. Focolai epidemici si sono ripetutamente verificati in ambienti collettivi a residenza temporanea, come ospedali o alberghi, navi da crociera, esposizioni commerciali, ecc. I casi di polmonite da Legionella di origine comunitaria si manifestano prevalentemente nei mesi estivo-autunnali, mentre quelli di origine nosocomiale non presentano una particolare stagionalità.
1.2. Fonti di infezione, modalità di trasmissione e fattori di rischio
Il genere Legionella comprende 61 diverse specie (sottospecie incluse) e circa 70 sierogruppi (Allegato 1), ma non tutte sono state associate a casi di malattia nell‟uomo. Legionella pneumophila è la specie più frequentemente rilevata nei casi diagnosticati (Fields et al., 2002) ed è costituita da 16 sieropgruppi di cui Legionella pneumophila sierogruppo 1, responsabile dell‟epidemia di Filadelfia, è causa del 95% delle infezioni in Europa e dell‟85% nel mondo.
Anche in Italia l‟analisi della distribuzione di specie e sierogruppi isolati nel nostro territorio ha confemato la prevalenza di Legionella pneumophila ed in particolare del sierogruppo 1 nei casi di malattia (Fontana et al., 2014).
Non è nota la dose infettante per l‟uomo. Neppure si conoscono le ragioni della diversa virulenza nelle differenti specie e sierogruppi di Legionella che tuttavia potrebbero essere attribuite alla idrofobicità di superficie, alla stabilità nell‟aerosol e alla capacità di crescere all‟interno delle amebe.
Non è noto neppure lo stato fisiologico di Legionella che causa l‟infezione, ma esso può includere sia la fase stazionaria di crescita sia quella logaritmica, come pure le cosiddette sporelike forms. Lo stato fisiologico di Legionella può essere importante in relazione alla virulenza, poiché essa aumenta quando il batterio è cresciuto nelle amebe, nella tarda fase stazionaria o quando è nella forma spore-like.
La legionellosi viene normalmente acquisita per via respiratoria mediante inalazione, aspirazione o microaspirazione di aerosol contenente Legionella, oppure di particelle derivate per essiccamento.
Le goccioline si possono formare sia spruzzando l‟acqua che facendo gorgogliare aria in essa, o per impatto su superfici solide. La pericolosità di queste particelle di acqua è inversamente proporzionale alla loro dimensione. Gocce di diametro inferiore a 5µ arrivano più facilmente alle basse vie respiratorie. Sono stati inoltre segnalati in letteratura casi di legionellosi acquisita attraverso ferita (Brabender et al., 1983; Lowry et al., 1991; Lowry and Tompkins, 1993). Non è mai stata dimostrata la trasmissione interumana della malattia.
Mentre la maggior parte dei primi casi di legionellosi sono stati attribuiti a particelle di acqua aerodisperse, contenenti batteri provenienti da torri di raffreddamento o condensatori evaporativi o sezioni di umidificazione delle unità di trattamento dell’aria, successivamente, numerose infezioni sono risultate causate anche dalla contaminazione di impianti di acqua potabile, apparecchi sanitari, fontane e umidificatori ultrasonici.
Eventi epidemici verificatisi in vari Paesi, che hanno riguardato frequentatori di fiere ed esposizioni nelle quali si sono create condizioni di rischio di infezione da sistemi generanti aerosol (piscine e vasche idromassaggio, esposte a fini dimostrativi, e fontane decorative), suggeriscono l’opportunità di considerare anche queste manifestazioni nell’anamnesi dei casi e nell’indagine epidemiologica.
In Italia negli ultimi venti anni gli eventi epidemici più rilevanti sono stati causati da torri di raffreddamento (Castellani et al, 1997;, Rota et al. 2005; Venezia, dati non pubblicati) o da impianti idrici di strutture turistico ricettive (Rota et al.2011) o probabilmente da più sorgenti (torri di raffreddamento e/o impianti idrici di abitazioni) Scaturro et al. 2014.
In Australia, Nuova Zelanda, Giappone, negli Stati Uniti e nel Regno Unito sono state descritte a più riprese delle infezioni da Legionella longbeachae associate all’utilizzo di terricci o composti (Cameron et al., 1991).
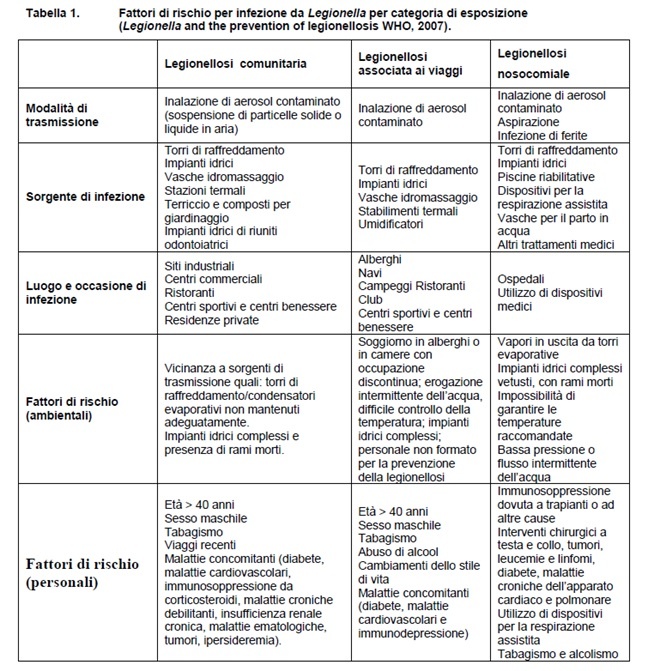
Fattori predisponenti la malattia sono l‟età avanzata, il fumo di sigaretta, la presenza di malattie croniche, l‟immunodeficienza. Il rischio di acquisizione della malattia è principalmente correlato alla suscettibilità individuale del soggetto esposto e al grado d‟intensità dell‟esposizione, rappresentato dalla quantità di Legionella presente e dal tempo di esposizione.
Sono importanti inoltre la virulenza e la carica infettante dei singoli ceppi di Legionella, che, interagendo con la suscettibilità dell‟ospite, determinano l‟espressione clinica dell‟infezione.
Malgrado il carattere ubiquitario di Legionella, la malattia umana rimane rara; i tassi d‟attacco nel corso di focolai epidemici sono bassi, inferiori al 5% (Edelstein, 1993).
La tabella 1 riassume e completa quanto sopra riportato.
1.3. Frequenza della malattia
Sebbene la sorveglianza epidemiologica della legionellosi sia notevolmente migliorata negli ultimi anni, grazie alla maggiore sensibilizzazione dei medici e alla disponibilità di un test diagnostico semplice e non invasivo (antigene solubile nelle urine), questa malattia resta sottodiagnosticata e anche sotto-notificata. Ecco perché nella maggior parte dei paesi è difficile determinare con precisione il tasso di morbosità e di mortalità. Nel 2012 in Europa sono stati riportati 5852 casi di legionellosi recensiti in 29 paesi europei. L’incidenza globale annuale della malattia in Europa nel 2012 si situa a 11,5 casi per 1.000.000 di abitanti, con un tasso di letalità del 9% (Fonte: ECDC, www.ecdc.europa.eu).
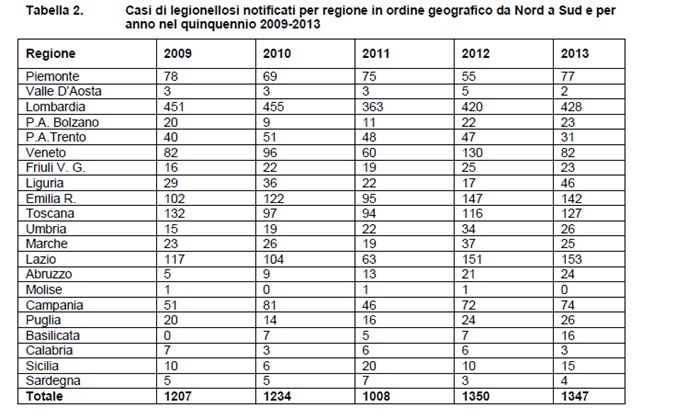
Nel 2013, secondo le notifiche pervenute all’ISS, l’incidenza della legionellosi in Italia è stata di 22,6 casi per 1.000.000 di abitanti con un tasso di letalità del 10,4%. Per informazioni più dettagliate, il lettore può consultare il sito dell’ISS http://www.iss.it/binary/publ dove sono pubblicati i dati epidemiologici a partire dal 1997. La Febbre di Pontiac e le altre infezioni extra-polmonari da Legionella non sono incluse nelle statistiche nazionali, nelle quali vengono conteggiate solo le polmoniti da Legionella confermate e probabili. In Tabella 2 è riportato il numero di casi di legionellosi notificato per regione, in Italia, negli ultimi cinque anni (Rota et al., 2012).
1.4. Sintomatologia
La legionellosi può manifestarsi con due distinti quadri clinici: la Febbre di Pontiac e la Malattia dei Legionari.
La Febbre di Pontiac, dopo un periodo di incubazione di 24-48 ore, si manifesta in forma acuta simil-influenzale senza interessamento polmonare, e si risolve in 2-5 giorni. I prodromi sono: malessere generale, mialgie e cefalea, seguiti rapidamente da febbre, a volte con tosse e gola arrossata. Possono essere presenti diarrea, nausea e lievi sintomi neurologici quali vertigini o fotofobia.
La prima epidemia di Febbre di Pontiac è stata causata da L. pneumophila di sierogruppo 1 mentre epidemie successive sono state attribuite a L. feeleii, L. anisa e L. micdadei.
La Malattia dei Legionari, dopo un periodo di incubazione variabile da 2 a 10 giorni (in media 5-6 giorni), si manifesta come una polmonite infettiva, con o senza manifestazioni extrapolmonari. La sindrome pneumonitica non ha caratteri di specificità né clinici né radiologici. Nei casi classificabili come gravi secondo il punteggio “pneumonia severity index” (Fine et al., 1997) può insorgere bruscamente con febbre, dolore toracico, dispnea, cianosi, tosse produttiva associati alla obiettività fisica semeiologica del consolidamento polmonare. Nei casi classificabili come di gravità lieve (ma che poi se non adeguatamente trattati possono evolvere in polmonite grave) l‟esordio può essere insidioso con febbre, malessere, osteoartralgie, tosse lieve, non produttiva. I quadri radiologici non sono patognomonici potendosi riscontrare addensamenti di tipo alveolare focali, singoli o multipli, monolaterali o disseminati con o senza evoluzione escavativa, come quadri inizialmente a impegno interstiziale.
A volte possono essere presenti sintomi gastrointestinali, neurologici e cardiaci; alterazioni dello stato mentale sono comuni, generalmente non associati a meningismo. In un paziente affetto da legionellosi, a impronta sistemica possono essere presenti uno o più dei seguenti segni e sintomi: bradicardia relativa, lieve aumento delle transaminasi, ipofosfatemia, diarrea e dolore addominale.
Tra le complicanze della legionellosi vi possono essere: ascesso polmonare, empiema, insufficienza respiratoria, shock, coagulazione intravasale disseminata, porpora trombocitopenica e insufficienza renale.
La polmonite da Legionella non ha quindi caratteristiche cliniche che permettano di distinguerla da altre forme atipiche o batteriche di polmonite comunitaria, né ha stigmate specifiche che consentano di sospettarla tra le eziologie di polmonite nosocomiale e/o dell‟ospite immunocompromesso.
Come tale va sempre sospettata sul piano clinico tra le infezioni polmonari comunitarie e nosocomiali. Non a caso le linee guida della American Thoracic Society prevedono antibiotici sempre attivi verso Legionella anche per le polmoniti comunitarie di lieve gravità e di considerare l‟eziologia in tutte le forme nosocomiali sino a quando non venga esclusa dalle indagini di laboratorio (American Thoracic Society, 2005; Mandell et al., 2007).
1.5 Diagnosi di laboratorio: ricerca di Legionella in campioni di provenienza umana
La polmonite da Legionella ha dei sintomi che sono spesso indistinguibili dalle polmoniti causate da altri microrganismi e, per questo motivo, la diagnosi di laboratorio della legionellosi deve essere considerata complemento indispensabile alle procedure diagnostiche cliniche. Gli accertamenti di laboratorio devono essere attuati possibilmente prima che i risultati possano essere influenzati dalla terapia e devono essere richiesti al fine di attuare una terapia antibiotica mirata, contenere così l‟uso di antibiotici non necessari, evitare effetti collaterali, l‟insorgenza di microrganismi antibiotico-resistenti, ed in ultimo, ma non meno importante, ridurre i tempi di degenza e le spese sanitarie del nostro paese.
Test diagnostici per la legionellosi dovrebbero essere idealmente eseguiti in tutti i seguenti casi di polmonite:
– in pazienti con malattia severa che richieda il ricovero in un reparto di terapia intensiva;
– in pazienti che riferiscano fattori di rischio (Tabella 1);
– in pazienti che siano stati esposti a Legionella durante un‟epidemia;
– in pazienti in cui nessun altra eziologia è probabile.
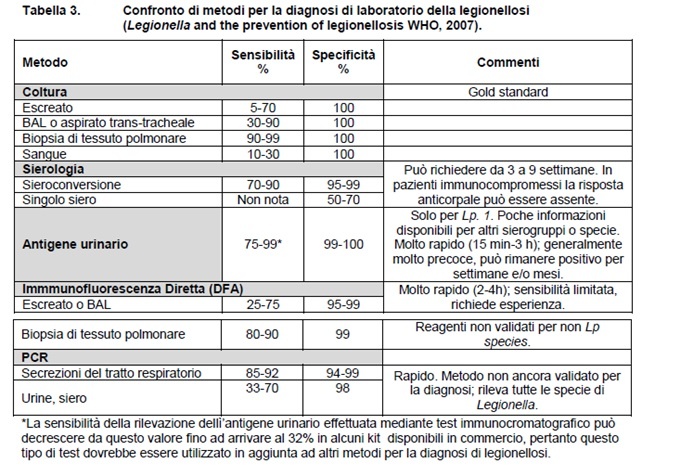
La sensibilità e specificità dei metodi diagnostici per L. pneumophila sierogruppo 1 sono abbastanza elevate mentre sono inferiori per gli altri sierogruppi di L. pneumophila o per altre specie di Legionella.
I metodi di diagnosi per l‟infezione da Legionella correntemente utilizzati sono i seguenti:
– isolamento del batterio mediante coltura;
– rilevazione di anticorpi su sieri nella fase acuta e convalescente della malattia;
– rilevazione dell‟antigene urinario;
– rilevazione del batterio nei tessuti o nei fluidi corporei mediante test di immunofluorescenza;
– rilevazione del DNA batterico mediante PCR (metodo non ancora validato). Si suggerisce vivamente l‟esecuzione di questo test come rapida analisi nei casi di polmonite sopra elencati. I campioni che da questo test avranno esito positivo, saranno saggiati poi mediante coltura. Questa pratica, adottata già da alcuni paesi europei, e suggerita dall‟ECDC, ha consentito di isolare un maggior numero di ceppi dai pazienti dando la possibilità di risalire alla fonte di infezione.
Tuttavia, poiché nessun metodo di diagnosi di legionellosi è sensibile e specifico al 100% (come indicato nei paragrafi successivi), è ormai opinione condivisa a livello internazionale, che maggiore è il numero di metodi diagnostici utilizzati, più corretta sarà la diagnosi di legionellosi.
Infatti, la negatività di uno o di tutti i test diagnostici utilizzati e validati non esclude che ci si possa trovare di fronte ad un caso di legionellosi.
In Tabella 3 sono indicati i vari metodi con le relative percentuali di sensibilità e specificità.
Metodo colturale
L‟isolamento mediante coltura è considerato il metodo diagnostico di elezione per la diagnosi di legionellosi. I campioni dovrebbero essere prelevati prima del trattamento antibiotico, sebbene Legionella sia stata isolata da secrezioni del tratto respiratorio e dal sangue anche dopo alcuni giorni di trattamento antibiotico.
I campioni del tratto respiratorio (BAL, tracheoaspirato, liquido pleurico) e il parenchima polmonare, dovrebbero essere tempestivamente coltivati (Allegato 2) (Stout et al., 2003).
Inoltre, un‟emocoltura negativa, seminata successivamente su terreno specifico per Legionella, può dar luogo all‟isolamento del microrganismo.
In alcuni casi Legionella è stata trovata in campioni provenienti da siti extra polmonari, specialmente in campioni autoptici (e.g., fegato, milza, fluido pericardico, reni, ascessi cutanei).
L‟isolamento del batterio richiede terreni di coltura specifici poiché Legionella non cresce sui terreni di uso comune (Allegato 2), ed ha tempi di crescita relativamente lunghi (4-10 giorni).
L‟analisi dei campioni clinici mediante coltura è estremamente importante, perché è il criterio diagnostico più specifico, permette l‟isolamento di tutte le specie e sierogruppi e consente lo studio comparativo con ceppi di Legionella isolati dall‟ambiente, presumibilmente associati all‟infezione, al fine di individuare la fonte dell‟infezione stessa.
L‟uso di colorazioni batteriologiche può essere solo parzialmente utile. Tuttavia, è necessario prendere in considerazione una diagnosi di legionellosi se si osservano batteri Gram-negativi nelle secrezioni delle basse vie respiratorie di un paziente immunocompromesso, con una coltura negativa dopo 24 ore sui terreni di uso corrente.
La coltura è particolarmente importante per la diagnosi in alcuni casi:
– pazienti in cui la polmonite è severa e causa insufficienza respiratoria;
– pazienti immunocompromessi;
– infezioni nosocomiali;
– casi in cui si sospetta che la causa sia Legionella appartenente a specie differenti da L. pneumophila sierogruppo 1.
Rilevazione dell’antigene urinario
La presenza dell‟antigene solubile di Legionella nelle urine (antigenuria) si rileva nella maggior parte dei pazienti da uno a tre giorni dopo l‟insorgenza dei sintomi, con un picco a 5-10 giorni; può persistere per alcune settimane o mesi, soprattutto in pazienti immunocompromessi, dove può persistere per quasi un anno (Kohler et al., 1984). Inoltre, essendo la sensibilità al test spesso associata alla gravità della malattia (Yzerman et al., 2002) per evitare una mancata diagnosi, nei casi di polmonite meno grave, si dovrebbe fare ricorso ad altri test diagnostici. La sua presenza, tuttavia, può essere a volte intermittente, ma si rileva anche in corso di terapia antibiotica (Luck et al., 2002). Questo test è attualmente validato esclusivamente per L. pneumophila sierogruppo 1, anche se, in una certa percentuale di casi, è stata riscontrata positività a seguito di infezioni causate da altri sierogruppi di Legionella (Benson et al., 2000; Olsen et al., 2009).
Pertanto la positività del test non implica necessariamente che l‟agente eziologico sia L. pneumophila sierogruppo 1, anche se questa è la situazione più frequente. La conferma può essere ottenuta solo con l‟utilizzo di altri metodi diagnostici (coltura, sierologia).
La determinazione può essere effettuata attraverso due metodi: metodo immunoenzimatico (EIA) e metodo immunocromatografico (ICT). Il trattamento del campione prima dell‟analisi è indicato nell‟Allegato 2.
Il metodo immunoenzimatico
L‟EIA ha una specificità dell‟80–85%, simile a quella della coltura (Svarrer CW et al., 2012; Helbig J et al 2003; Hackman et al., 1996; Kazandjian et al., 1997), ma una sensibilità maggiore. La determinazione dell‟antigene urinario mediante EIA è il metodo di scelta per la diagnosi di infezione da L. pneumophila sierogrouppo 1 (Svarrer CWet al., 2012;Cosentini et al., 2001; Formica et al., 2001;).
Il metodo immunocromatografico
E‟ un saggio molto rapido (15 min-1h) per la rilevazione dell‟antigene di L. pneumophila sierogruppo 1 che non richiede particolari attrezzature di laboratorio.
L‟interpretazione dei risultati si basa sulla presenza o meno di due bande colorate, una del campione e l‟altra del controllo. Qualsiasi linea visibile dà un risultato positivo. Tuttavia, campioni con bassa concentrazione di antigene potrebbero dare una linea di campione debole che può essere considerata “positiva” con sicurezza se aumenta in intensità, dopo 45‟ dalla prima osservazione (questo controllo è possibile solo con il test oggetto della pubblicazione di Helbig et al., 2001). Se la banda debole non aumenta di intensità, soprattutto nei casi in cui le urine sono patologiche in partenza (infezioni urinarie, proteinuria, ecc.) il referto deve essere formulato come dubbio, in attesa di essere confermato da altri test (Helbig et al., 2001).
Confrontato con altri metodi diagnostici, il test dell‟antigene urinario presenta evidenti vantaggi: i campioni sono ottenuti facilmente, è rilevabile nelle fasi precoci della malattia e il test è facile e rapido da effettuare, oltre che specifico. Inoltre può essere rilevato anche nella Febbre di Pontiac (Burnsed et al., 2007).
Uno svantaggio consiste nel fatto che, proprio per la sua persistenza, può risultare difficile distinguere tra infezione acuta, fase di convalescenza o infezione pregressa.
In casi sospetti, in presenza di segni clinici di polmonite, oltre al test dell‟antigene urinario andrebbe effettuato un ulteriore test diagnostico (esame colturale, sierologico e PCR), anche se, come dimostrato da recenti studi (Svarrer et al., 2012), questa pratica dovrebbe essere sempre adottata a causa della non elevata sensibilità soprattutto del test immunocromatografico. Un altro limite del test è che rileva prevalentemente gli antigeni di L. pneumophila sierogruppo 1.
Inoltre, benché la sensibilità complessiva del test sia pari al 75-99% per infezioni dovute a tale microrganismo, è da rilevare che la sensibilità può variare in particolari sottopopolazioni: pazienti con legionellosi associata ai viaggi, legionellosi acquisita in comunità e nosocomiale.
Infatti, in queste tre categorie la sensibilità è rispettivamente pari al 94%, 76-87% e 44-46% (Helbig et al., 2003). Queste differenze sono dovute al fatto che il test rileva principalmente alcuni ceppi di L. pneumophila che sono predominanti nei casi di legionellosi associata ai viaggi.
Falsi positivi sono stati descritti in pazienti con malattia da siero (Deforges et al., 1999) e in infezioni ascrivibili a Nocardia asteroides (Bailleul et al., 2004) ed in un episodio pseudoepidemico correlato ad alcuni lotti di un test immunocromatografico fallaci (Rota et al. 2014). Uno studio sistematico che ha saggiato il test con numerosi ceppi di Legionella ha rilevato una totale assenza di reattività di antigeni di specie di Legionella non-pneumophila (Okada et al., 2002).
Per rendere più affidabile la diagnosi mediante rilevazione dell‟antigene urinario è consigliabile bollire le urine (vedi paragrafo dedicato nell‟Allegato 2). La concentrazione delle urine migliora la sensibilità del test anche se può interferire con la specificità (Svarrer CW et al 2012).
Metodi sierologici
Immunofluorescenza indiretta (IFI)
I metodi sierologici sono utili per indagini epidemiologiche retrospettive ma sono meno validi per quelle cliniche, data la comparsa talvolta tardiva degli anticorpi specifici a livelli significativi e a causa della necessità di controllare un ulteriore campione di siero in fase di convalescenza.
Un aumento significativo del titolo anticorpale si presenta da 1 a 9 settimane dopo l‟insorgenza della malattia in circa i tre quarti dei pazienti con coltura positiva per L. pneumophila sierogrouppo 1. In media i pazienti sviluppano anticorpi in due settimane, tuttavia oltre il 25% delle sieroconversioni non viene rilevato perché i sieri non vengono correttamente prelevati nella fase precoce e convalescente della malattia. Inoltre la determinazione della classe anticorpale non è d‟aiuto nel differenziare tra un‟infezione in atto e un‟infezione pregressa. In alcuni studi le IgM si riscontano precocemente, altri studi hanno dimostrato che in questa fase ci sono sia IgM che IgG. In alcuni pazienti inoltre sono state riscontrate solo le IgG o solo le IgM, oppure possono persistere a lungo le IgM. Le IgA possono essere presenti in infezioni recenti ma vanno incontro a degradazione. Per questo motivo è opportuno utilizzare un test che metta in evidenza tutte le classi anticorpali.
Un aumento di quattro volte o più del titolo anticorpale tra due sieri prelevati nella fase acuta e convalescente della malattia ha valore diagnostico.
Un risultato positivo su un singolo siero (≥256) ha un valore diagnostico presuntivo. La definizione di questi criteri aiuta ad evitare falsi positivi dovuti a reazioni crociate con altri patogeni. In generale, il metodo sierologico ha un valore predittivo positivo (proporzione di realmente malati tra i positivi al test) piuttosto basso. Inoltre si possono avere falsi negativi a causa della scarsa risposta anticorpale di pazienti con polmonite da Legionella che generalmente hanno difese immunitarie compromesse oppure a causa della sieroconversione a volte molto tardiva, oppure semplicemente a causa dell‟età avanzata in cui si verifica un naturale declino della risposta immunitaria. La sieroconversione può anche non essere osservata se nel test si utilizza un antigene non omologo (esistono ad esempio diversi sottotipi di L. pneumophila) che non reagisce con gli anticorpi sviluppati dal contatto con un altro sottotipo che può aver causato l‟infezione.
Si deve infine rilevare che la specificità e la sensibilità dell‟immunofluorescenza indiretta è stata valutata solo per L. pneumophila sierogruppo 1; la sensibilità e la specificità per altri sierogruppi o specie non sono note (Luck et al., 2002; Muder, 2000).
A causa della formazione di anticorpi cross-reattivi, circa il 50% dei pazienti infettati con L. pneumophila non-sierogrouppo 1 manifesta una sieroconversione con antigeni specifici di L. pneumophila sierogrouppo 1 (Edelstein, 2002). Un risultato negativo non esclude la diagnosi di legionellosi. Inoltre le preparazioni antigeniche differiscono nei diversi laboratori e tra le ditte produttrici di kit, e ciò produce diversi livelli anticorpali critici, pertanto per alcune preparazioni antigeniche la specificità potrebbe essere relativamente alta per un certo campione e bassa per un altro (Rose et al, 2002). L‟esistenza di reattività crociata tra Legionelle e altri microrganismi come ad esempio Campylobacter e Pseudomonas species (Boswell, 1996; Marshall et al., 1994), e la difficoltà di distinguere tra infezione in atto o infezione pregressa in caso di campione singolo di siero o di titolo anticorpale costante, rende la conferma diagnostica più complessa .
Microagglutinazione ed ELISA
Sono test sierologici più specifici per L. pneumophila sierogruppo 1 (Edelstein, 2002).
La microagglutinazione è un metodo rapido ed economico che permette di evidenziare anticorpi appartenenti essenzialmente, alla classe IgM, per questo motivo, e per tutto quanto detto in merito alla risposta anticorpale è una tecnica scarsamente utilizzata nella diagnosi di legionellosi.
Il metodo ELISA viene utilizzato sempre più frequentemente nei laboratori di diagnostica, grazie alla diffusione di numerosi kit commerciali; la concordanza tra il test ELISA e l‟immunofluorescenza è del 91% circa (Edelstein, 2002). La sensibilità è tra l‟80% e il 90% e la specificità è di circa il 98%.
Immunofluorescenza diretta (DFA)
L‟evidenziazione di Legionella nei campioni clinici per mezzo dell‟immunofluorescenza diretta, pur permettendo di confermare la diagnosi di polmonite da Legionella entro poche ore, ha una validità inferiore al metodo colturale. La tecnica si esegue in 2-3 ore circa, richiede una certa preparazione ed esperienza nella lettura del preparato ed è influenzata dalla specificità degli antisieri utilizzati e dalle dimensioni del preparato esaminato (Allegato 2). La DFA effettuata su escreato può dare risultati positivi fino a 2–4 giorni dopo l‟inizio della terapia antibiotica e spesso anche per periodi più lunghi in casi di polmonite cavitaria (Luck et al., 2002).
La DFA è un metodo efficace con campioni di espettorato, aspirati endotracheali e transtracheali e su biopsie polmonari (Stout et al., 2003). Pazienti con legionellosi diagnosticata mediante coltura hanno una DFA positiva tra il 25% e il 70%, tuttavia la specificità del test è superiore al 99,9%. Pertanto un risultato negativo non esclude la diagnosi di legionellosi, ma un risultato positivo ha quasi sempre un valore diagnostico se la lettura del vetrino è stata fatta in modo corretto. Molta attenzione deve essere posta per prevenire i falsi positivi in DFA, quando i campioni sono stati a contatto con acqua o tamponi contaminati.
L‟uso della coltura o dell‟immunofluorescenza diretta è diminuito e la maggior parte dei casi di legionellosi è attualmente diagnosticata mediante rilevazione dell‟antigene urinario. Come conseguenza di questo cambiamento la rilevazione di Lp1 è aumentata, ma tutti gli altri sierogruppi o specie sono sotto-diagnosticati.
Amplificazione di geni specifici mediante PCR
La diagnosi di legionellosi in campioni clinici mediante Polymerase Chain Reaction (reazione a catena della polimerasi o PCR) si basa sulla determinazione della presenza di DNA genomico di Legionella, attraverso amplificazione di geni specifici (Cloud et al., 2000; Murdoch, 2003). L‟introduzione della Real-Time PCR ha invece, rispetto alla PCR classica, il vantaggio di visualizzare la reazione in tempo reale, dando eventualmente anche informazioni sulla quantità di DNA presente nel campione. Per questo è molto spesso denominata anche PCR quantitativa (q-PCR). La Real-Time PCR è stata applicata per la singola determinazione di infezione da L. pneumophila e/o Legionella species (Templeton et al., 2003). Più recentemente inoltre sono stati pubblicati numerosi articoli in cui sono descritti protocolli di “multiplex realtime PCR” per la diagnosi di polmoniti causate da Legionella, in cui si evidenziano contemporaneamente Legionella pneumophila sierogruppo 1, tutti i sierogruppi di Legionella pneumophila e le altre specie di Legionella (Benitez AJ, Winchell JM, 2013). Attraverso la multiplex real-time PCR sono stati sviluppati anche dei saggi attraverso i quali è possibile mettere in evidenzia simultaneamente il DNA di Legionella e di alcuni dei microorganismi più frequentemente associati con le infezioni polmonari quali Chlamydia, Mycoplasma, Streptococcus (Nomanpour et al 2012; Al-Marzooq et al 2011, McDonough et al., 2005).
Gli articoli pubblicati illustrano come la diagnosi mediante amplificazione di geni specifici sia vantaggiosa rispetto all‟esame colturale perché richiede tempi di analisi di poche ore, ed ha una sensibilità pari, se non superiore, all‟esame colturale, pur utilizzando quantità minime di DNA genomico. La sensibilità della PCR dipende dal tipo di campione: è più elevata (> 99%) per analisi effettuate su campioni del tratto respiratorio (espettorato, broncoaspirato, broncolavaggio) e si riduce per campioni rappresentati da altri liquidi corporei (sieri o urine) (Murdoch 2003; Aoki et al., 2003; Diederen et al., 2007). La specificità è data dal gene e/o dalla porzione di gene target scelto per l‟amplificazione. I geni target più frequentemente analizzati sono: mip, 16S rDNA, 5S rDNA.
I saggi di Real-Time PCR per la rilevazione di Legionella su campioni clinici hanno il vantaggio rispetto alla PCR qualitativa di ridurre il rischio di contaminazione del campione, minimizzare il tempo di analisi ed essere ancora più specifici. Inoltre, rispetto ai metodi classici di identificazione, la Real-Time PCR permette il riconoscimento delle numerose specie ad oggi identificate e di tutti i sierogruppi della specie pneumophila.
1.6 Ricerca di Legionella in campioni di provenienza ambientale
Metodo colturale
A livello internazionale sono state redatte due norme che descrivono la determinazione di Legionella in matrici ambientali: ISO 11731-1:1998 “Water quality- detection and enumeration of Legionella” e ISO N. 11731-2: 2004 “Water quality- detection and enumeration of Legionella” Part 2: “Direct membrane filtration method for waters with low bacterial counts”.
Le matrici ambientali che vengono generalmente utilizzate per la ricerca di Legionella in campioni ambientali sono: acqua, sedimenti, biofilm.
Il metodo analitico è riportato nell‟Allegato 4.
Real-Time PCR
La prima norma relativa all‟uso di questa metodologia è stata elaborata dall‟Association Française de Normalisation (AFNOR) che ha sviluppato uno standard (Détection et quantificationdes Legionella et/ou Legionella pneumophila par concentration et amplification génique par réaction de polymérisation en chaîne (PCR) NF T90-471, 2010) per assicurare l‟equivalenza dei risultati ottenuti da differenti q-PCR (Anon., 2010) e alcuni kit commerciali sono stati messi a punto sulla base di tale norma.
Recentemente è stata pubblicata la norma ISO “Water quality- Detection and quantification of Legionella spp and/or Legionella pneumophila by concentration and genic amplification by quantitative polymerase chain reaction (qPCR)” (ISO/TS 12869, 2012) che aggiorna e specifica i requisiti metodologici, di valutazione e controllo di qualità del metodo qPCR applicato a Legionella. Tale normativa detta le linee-guida per l‟elaborazione di un metodo affidabile e riproducibile tra differenti laboratori. Tuttavia, a meno di non disporre di un sistema per l‟analisi di DNA di Legionella mediante PCR per il quale siano stati verificati tutti i criteri di un metodo standard, la qPCR resta non validato. Inoltre, poiché, così come specificato nella stessa norma, la qPCR non da informazione riguardo lo stato delle cellule, la quantificazione dovrà sempre essere determinata mediante esame colturale.
Alcuni studi condotti al fine di confrontare il metodo colturale con la Real-Time PCR mostrano un più elevato numero di campioni positivi e valori più alti di quantificazione rilevati con la Real-Time PCR rispetto alla coltura (Behets et al., 2007; Buchbinder et al., 2002; Joly et al., 2006a; Levi et al., 2003; Yamamoto et al., 1993; Yaradou et al., 2007). Diverse ragioni sono state indicate per spiegare queste differenze tra cui le più importanti sono la rilevazione di DNA di batteri morti o danneggiati o di cellule vitali ma non coltivabili, oppure di DNA di Legionella intra-amoeba (Alleron et al., 2008; Shih and Lin, 2006). Ciò che maggiormente limita l‟uso della qPCR rispetto alla coltura è che nella legislazione nazionale, così come in quella europea e dell‟OMS, i livelli di azione sono espressi in unità formanti colonia per litro e non in unità genomiche per litro e non esiste a tutt‟oggi un consenso di come i risultati ottenuti da un metodo possano essere raffrontati con quelli ottenuti dall‟altro. In uno studio multicentrico internazionale, recentemente pubblicato, è stato analizzato un numero elevato di campioni ambientali e i risultati ottenuti da analisi mediante qPCR e mediante coltura sono stati confrontati (Lee et al., 2011). L‟elaborazione dei dati raccolti ha consentito la determinazione di livelli di allerta e/o di azione espressi come unità genomiche per litro che comunque sono strettamente legati al tipo di protocollo di qPCR utilizzato come confronto con il metodo colturale.
Poiché la q-PCR è effettivamente vantaggiosa per molteplici aspetti ma non ancora validata a livello internazionale, essa può, ad oggi, essere solo consigliata per una rapida analisi di numerosi campioni prelevati da siti probabilmente associati ad un caso o ancor più a un cluster di legionellosi, potendo in tempi brevi escludere i siti negativi ed identificare quelli positivi. I campioni risultati positivi devono essere comunque analizzati con il metodo colturale.
1.7 Terapia
I batteri appartenenti al genere Legionella sono microrganismi essenzialmente intracellulari. Di conseguenza, tutti gli agenti antimicrobici efficaci nel trattamento delle legionellosi devono essere in grado di concentrarsi ed essere attivi a livello intracellulare (Horwitz, 1983). Inoltre, questi stessi farmaci devono essere in grado di distribuirsi e persistere adeguatamente nei tessuti infetti da Legionella. La Febbre di Pontiac ha una evoluzione benigna anche in assenza di specifico trattamento chemioterapico. Tutte le altre malattie sostenute da Legionella species, dalle più comuni polmoniti, alle meno frequenti infezioni extrapolmonari, viceversa, richiedono un trattamento specifico per ridurre la probabilità di un esito infausto.
Gli antibiotici che rispondono adeguatamente ai suddetti requisiti sono i chinoloni, i macrolidi e, con minor efficienza, le tetracicline. Al contrario, tutte le betalattamine, i carbapenem, gli aminoglicosidi ed il cloramfenicolo sono inutili per il trattamento delle legionellosi in quanto non raggiungono concentrazioni intracellulari in grado di esplicare un effetto antibatterico (Edelstein and Cianciotto, 2005).
Sulla base di numerosi studi condotti in vitro misurando l‟attività anti-Legionella (nella maggior parte dei casi L. pneumophila sierogruppo 1) in macrofagi alveolari polmonari di cavie e, meno frequentemente, in monociti umani o altre linee cellulari, i chinoloni (in particolare la levofloxacina) sono risultati superiori ai macrolidi Tra questi ultimi, azitromicina è apparsa superiore a claritromicina, ed entrambi questi due farmaci si sono dimostrati superiori alla eritromicina (Edelstein and Cianciotto, 2005; Pedro-Botet and Yu, 2006). Sul piano clinico non esistono studi prospettici randomizzati di paragone tra un macrolide ed un chinolone o fra antibiotici appartenenti alla stessa classe di farmaci nel trattamento della polmonite da Legionella. Infatti, gli unici dati disponibili in letteratura fanno riferimento a studi osservazionali. Tra questi quelli più validi in termini di numero di casi osservati sono tre, tutti pubblicati nel 2005 (Blazquez Garrido et al., 2005; Mykietiuk et al., 2005; Sabria et al., 2005): due sono retrospettivi ed uno prospettico. Visti nel loro complesso i dati cumulativi dei tre studi riguardarono 658 pazienti, di cui 221 trattati con un macrolide e 237 con un chinolone. I pazienti trattati con il chinolone ebbero una più rapida defervescenza (mediamente in 66 ore, contro 97 ore con il macrolide), una minore durata della degenza ospedaliera (mediamente 6,6 giorni, contro 9,0 con il macrolide) una minore incidenza di complicanze, quali ascessocavitazione polmonare, empiema pleurico, shock settico, necessità di supporto respiratorio con ventilazione meccanica (8,4% contro 18,5% con il macrolide) e una più bassa mortalità (2,1% contro 4,5% con il macrolide). Anche gli effetti collaterali indesiderati furono 12,5% con il chinolone contro 23,4% con il macrolide.
Nel considerare questi dati è importante tuttavia tener conto che, mentre tra i chinoloni il farmaco impiegato fu in tutti i casi, con solo 4 eccezioni, la levofloxacina, per i macrolidi furono impiegate due possibili opzioni: claritromicina, nella maggior parte dei casi, ed eritromicina (Blazquez Garrido et al., 2005; Murdoch, 2003; Mykietiuk et al., 2005; Sabria et al., 2005). Giova ricordare che entrambi questi due macrolidi risultano meno efficaci di azitromicina nei confronti di Legionella in vari modelli di attività intracellulare; inoltre proprio azitromicina, unico dei macrolidi, ha dimostrato in alcuni esperimenti in vitro la stessa efficienza anti-Legionella dei chinoloni (Pedro-Botet and Yu, 2006). Pertanto sul piano clinico non vi è al momento evidenza della superiorità dei chinoloni, e in particolare di levofloxacina, su azitromicina nel trattamento delle legionellosi.
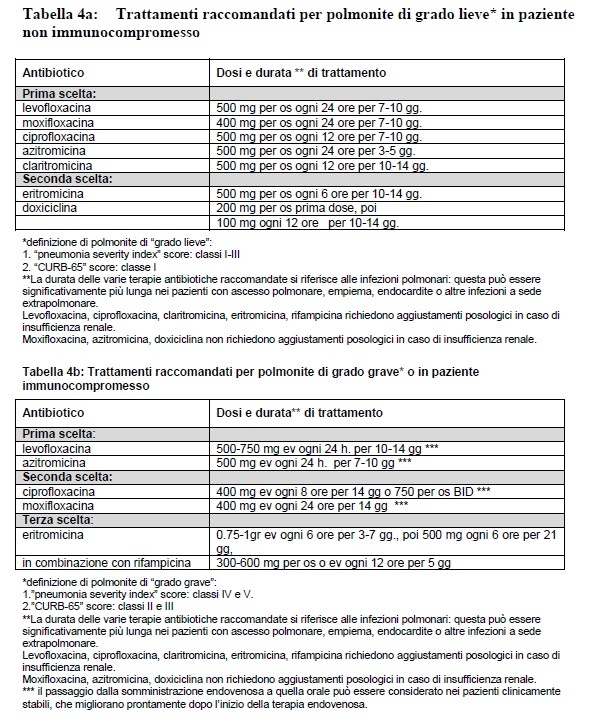
A far spostare l‟ago della bilancia leggermente a favore della levofloxacina sono una serie di considerazioni. Innanzitutto esiste una vasta esperienza con questo farmaco, che è superiore rispetto a tutti gli altri farmaci anti-Legionella. Un dato estremamente impressionante fu lo 0% in termini di mortalità che fu registrato nei sei studi clinici condotti per la approvazione del farmaco da parte della Food and Drug Administration (Yu et al., 2004). Infine, il più ampio spettro antimicrobico (esteso ai ceppi penicillina-macrolide resistenti di Streptococcus pneumoniae, Staphylococcus aureus meticillina sensibile, Pseudomonas aeruginosa e le enterobacteriaceae, che possono co-infettare pazienti resi immunodeficienti dalla stessa malattia da Legionella) di levofloxacina rispetto a tutti gli altri antibiotici anti-Legionella (Edelstein and Cianciotto, 2005). Azitromicina, come mostra la Tabella 4b, rappresenta comunque una prima scelta nella terapia della legionellosi.
Sulla base di tutte le osservazioni e considerazioni menzionate nel presente paragrafo, e sintetizzando le opinioni riportate da esperti in trattati di riferimento (Edelstein and Cianciotto, 2005; Gilbert et al., 2008), è stata elaborata la Tabella 4 ove le varie opzioni terapeutiche sono indicate in prima, seconda o terza scelta per il trattamento di polmoniti da Legionella con diverso grado di gravità e/o in pazienti con diverso grado di immunocompetenza.
La durata delle varie terapie antibiotiche indicate in Tabella 4a e 4b si riferisce alle infezioni polmonari non complicate: ascessi polmonari, empiemi pleurici, endocarditi o altre infezioni extrapolmonari possono richiedere trattamenti assai prolungati, secondo il giudizio del clinico infettivologo. Deve essere sottolineato che le polmoniti da Legionella comportano alterazioni radiologiche che regrediscono assai lentamente, a volte solo dopo cinque-sei mesi, così come un‟antigenuria che può persistere positiva per mesi (Edelstein and Cianciotto, 2005). Per questo motivo tali esami non vanno considerati per modificare la durata “standard” delle varie terapie antibiotiche.